VALE ET AMA ME. БУДЬ ЗДОРОВ И ЛЮБИ МЕНЯ
Ученым редко аплодируют стоя. Обычно по завершении выступления и просьбы модератора к аудитории задавать вопросы следует неловкое молчание. Но после того как южноафриканская исследовательница Линда-Гейл Беккер (Linda-Gail Bekker) закончила доклад на AIDS 2024, 25-й Международной конференции по СПИДу, проходившей в конце июля 2024 года в Мюнхене (Германия), публика встала и аплодировала почти минуту.
«Это воочию отражает, насколько велик энтузиазм».
Юрген Рокштро (Jürgen Rockstroh), руководитель амбулаторной клиники ВИЧ-инфекции при Боннском университете (Германия).
Беккер рассказала присутствовавшим, что среди более чем 2 тыс. африканских женщин, которые дважды в год получали подкожные инъекции противовирусного препарата ленакапавир (lenacapavir) в качестве доконтактной профилактики (PrEP) инфекции ВИЧ, ни одна не заразилась. Кажется, мы становимся свидетелями истинной революции в борьбе с этой инфекцией.
«Представьте, у вас есть вакцина, которая на 100% эффективна, и для поддержания защиты нужно ревакцинироваться каждые 6 месяцев. Вы бы точно сказали, что наконец-то появилось средство, благодаря которому с эпидемией будет покончено».
Крис Бейрер (Chris Beyrer), глава Института глобального здравоохранения Дьюка (Duke Global Health Institute, DGHI, Дарем, шт. Северная Каролина, США).
«Гилеад сайенсиз» (Gilead Sciences), разработавшая ленакапавир, поделилась основными результатами клинического испытания PURPOSE 1 (NCT04994509) фазы III в конце июня 2024 года [1]. Но наблюдатели решили повременить с выводами до получения подробных данных, в том числе о побочных эффектах и методологии исследования. В конце июля долгожданная информация была представлена в докладе Беккер и сопутствующей научной публикации в авторитетном The New England Journal of Medicine [2] [3].
«Опубликованные результаты оказались лучше, чем кто-либо надеялся. Успех ленакапавира, безусловно, усложнит и без того растянувшийся на десятилетия поиск вакцины против ВИЧ».
Винсент Мутури-Киои (Vincent Muturi-Kioi), руководитель разработки вакцин против ВИЧ из Международной инициативы по вакцинации против СПИДа (International AIDS Vaccine Initiative, IAVI, Нью-Йорк, США).
Окажутся ли итоги клинического испытания PURPOSE 2 (NCT04925752) фазы III среди мужчин, практикующих секс с мужчинами (МСМ), — одной из целевой групп PrEP, столь же многообещающими? Результаты будут собраны в конце этого — начале следующего года. Неясно также, как скоро ленакапавир получит регуляторное одобрение, сколько он будет стоить (особенно в странах с низким и средним уровнем доходов), как быстро вирус выработает к нему резистентность.
«Пройдут шесть месяцев, прежде чем появятся результаты второго испытания ленакапавира. За это время еще 650 тыс. человек заразятся ВИЧ».
Эндрю Хилл (Andrew Hill), научный сотрудник кафедры трансляционной медицины Ливерпульского университета (University of Liverpool, UOL, Ливерпуль, Великобритания) и член Комитета Всемирной организации здравоохранения (ВОЗ) по справедливому ценообразованию (WHO Fair Pricing Committee).
Если всё сложится удачно, ленакапавир для PrEP увидит свет ближе к концу 2025 года.
Успехи ленакапавира вселяют надежду, тем более эпидемиологи отмечают критический момент с распространением ВИЧ. Число новых случаев инфицирования снизилось с 2,1 млн в 2010 году до 1,3 млн в 2023-м. Однако, согласно свежему отчету Объединенной программы ООН по ВИЧ/СПИДу (ЮНЭЙДС), прогресс в этом направлении остановился, и мир, который «сбился с пути», не достигнет, похоже, ранее поставленной цели выйти на уровень менее 370 тыс. новых заражений к 2025 году, а к 2030-му полностью искоренить СПИД на планете. Финансирование профилактики ВИЧ сокращается по всему миру, четверть инфицированных не получает лечения, а регрессивная политика авторитарных правительств препятствует доступу к профилактике [4] [5] [6].
«Ленакапавир — прорывное достижение медицинское науки с огромным потенциалом в области общественного здравоохранения. Ленакапавир поможет ускорить глобальный прогресс в профилактике ВИЧ».
Шэрон Льюин (Sharon Lewin), директор Института инфекции и иммунитета Питера Дохерти (Peter Doherty Institute for Infection and Immunity) при Мельбурнском университете (University of Melbourne, Мельбурн, Австралия), бывший президент Международного общества борьбы со СПИДом (International AIDS Society, IAS, Женева, Швейцария).

Существующие стратегии PrEP, доступные с 2012 года, безопасны и эффективны, но их влияние на глобальную эпидемиологическую ситуацию оказалось весьма ограниченным. Так, «Трувада» (Truvada, эмтрицитабин + тенофовира дизопроксила фумарат; FTC/TDF) и «Дескови» (Descovy, эмтрицитабин + тенофовира алафенамида фумарат; FTC/TAF), профилактические препараты авторства всё той же «Гилеад», предполагающие каждодневный пероральный прием, не снизили риск заражения среди женщин в странах с высоким бременем ВИЧ-инфекции. Стигма и отсутствие конфиденциальности или самостоятельности в принятии решений мешают принимать таблетки по назначению.
«Молодым людям сложнее придерживаться каких-либо правил: они постоянно заняты, их жизнь насыщена, им есть чем заняться, где побывать. В случае с PrEP-таблетками нужно каждый день принимать решение, и это не так просто, как кажется. С инъекциями такое решение принимается всего два раза в год, причем всё можно обставить так, что никто точно ничего не узнает: как будто вы отлучаетесь под видом получения контрацептива».
Линда-Гейл Беккер (Linda-Gail Bekker), исполнительный директор Фонда здоровья Десмонда Туту (Desmond Tutu Health Foundation, DTHF) при Кейптаунском университете (University of Cape Town, UCT, Кейптаун, ЮАР), бывший президент Международного общества борьбы со СПИДом (International AIDS Society, IAS, Женева, Швейцария).
Женщины могут воспользоваться «Дапиринг» (DapiRing, дапивирин; DPV-VR) — вагинальным кольцом, которое на протяжении месяца организует ВИЧ-защиту на локальном уровне, то есть противодействует его передаче исключительно при вагинальном сексе.
«Апретуд» (Apretude, каботегравир; CAB-LA), предложенный «Виив хелскеа» (ViiV Healthcare) в конце 2021 года инъекционный профилактический препарат, который вводится внутримышечно каждые 2 месяца, внедряется в клиническую практику слишком медленно, отчасти из-за продолжающихся переговоров о ценах. Опять же, даже снижение стоимости до $180 на человека в год — всё еще слишком дорого для развивающихся стран [7].
«Ленакапавир — самый важный инструмент за последние 30 лет, который мы обрели, чтобы повсеместно покончить с эпидемией ВИЧ».
Дэниел О’Дэй (Daniel O’Day), председатель правления и исполнительный директор «Гилеад сайенсиз» (Gilead Sciences).
В клиническом исследовании PURPOSE 1 цисгендерные девочки-подростки и молодые женщины (16–25 лет; n=2134) из ЮАР и Уганды получали инъекции подкожные ленакапавира каждые 6 месяцев. Испытание завершилось досрочно, когда половина участниц продержалась 1 год, а препарат показал 100-процентную защиту: 0 случаев заражения после полового контакта с цисгендерными мужчинами. Две другие группы, ежедневно принимавшие «Труваду» (n=1068) или «Дескови» (n=2136), столкнулись с 16 и 39 случаями инфицирования соответственно, что ненамного меньше того, как если бы они вообще не следовали курсом PrEP. Впрочем, затем выяснилось, что добровольцы в группах пероральной профилактики очень плохо придерживались защитного режима, постоянно пропуская каждодневную дозу: только одна пятая участниц делали это более-менее должным образом.
«Когда я увидела столь поразительное зрелище — строчку нулей в графе данных о новых инфекциях, — меня пробрала холодная дрожь. После всех наших многолетних огорчений, особенно из-за вакцин, это казалось нереальным. Я буквально разрыдалась».
Линда-Гейл Беккер (Linda-Gail Bekker), исполнительный директор Фонда здоровья Десмонда Туту (Desmond Tutu Health Foundation, DTHF) при Кейптаунском университете (University of Cape Town, UCT, Кейптаун, ЮАР), бывший президент Международного общества борьбы со СПИДом (International AIDS Society, IAS, Женева, Швейцария).

Вопрос, сможет ли ленакапавир разрушить стагнирующую ситуацию, пока открыт. Поскольку он вводится подкожно, то при неаккуратной инъекции могут образовываться болезненные узелки и воспаления. К примеру, небольшое число участниц столкнулось с кожными изъязвлениями, после того как медсестра, по-видимому, сделала недостаточно глубокую инъекцию — и это в контексте строго контролируемого клинического испытания.
«Поразительно, но придется проводить обучение медицинских работников, как правильно делать уколы. Это обязательно, учитывая грядущее расширение масштабов использования ленакапавира».
Джинни Марраццо (Jeanne Marrazzo), директор Национального института аллергии и инфекционных заболеваний США (National Institute of Allergy and Infectious Diseases, NIAID, Бетесда, шт. Мэриленд, США).
Активисты призвали сделать ленаканавир доступным по разумной и справедливой цене во всём мире.
Реакция «Гилеад» была уклончива и обтекаема: мол, до момента регуляторного одобрения ленакапавира для задач PrEP говорить о его стоимости преждевременно, но при любом раскладе ценообразование не будет отталкиваться от нынешней стоимости препарата «Санленка» (Sunlenca, ленакапавир), разрешенного для лечения ВИЧ с мультилекарственной устойчивостью (МЛУ). Без каких-либо подробностей компания из Фостер-Сити пообещала, что в рамках добровольного лицензирования позволит генерическим производителям выпускать копии ленакапавира для стран с «высоким уровнем заболеваемости и ограниченными ресурсами, к которым в первую очередь относятся страны с низким и ниже среднего уровнем дохода» [8] [9].
«„Гилеад“ в своей традиционной манере исключила страны со средним уровнем дохода, потому что рассчитывает на получение более высокой цены на этих территориях. Предполагается, что доступ к недорогому ленакапавиру будет предоставлен только странам с низким и доходом ниже среднего уровня, хотя на страны с доходом выше среднего, в которых миллионы людей живут в бедности, приходится 41% новых случаев заражения ВИЧ».
Винни Бьяньима (Winnie Byanyima), исполнительный директор Объединенной программы Организации Объединенных Наций по ВИЧ/СПИДу (ЮНЭЙДС) [Joint United Nations Programme on HIV and AIDS, UNAIDS, Женева, Швейцария].
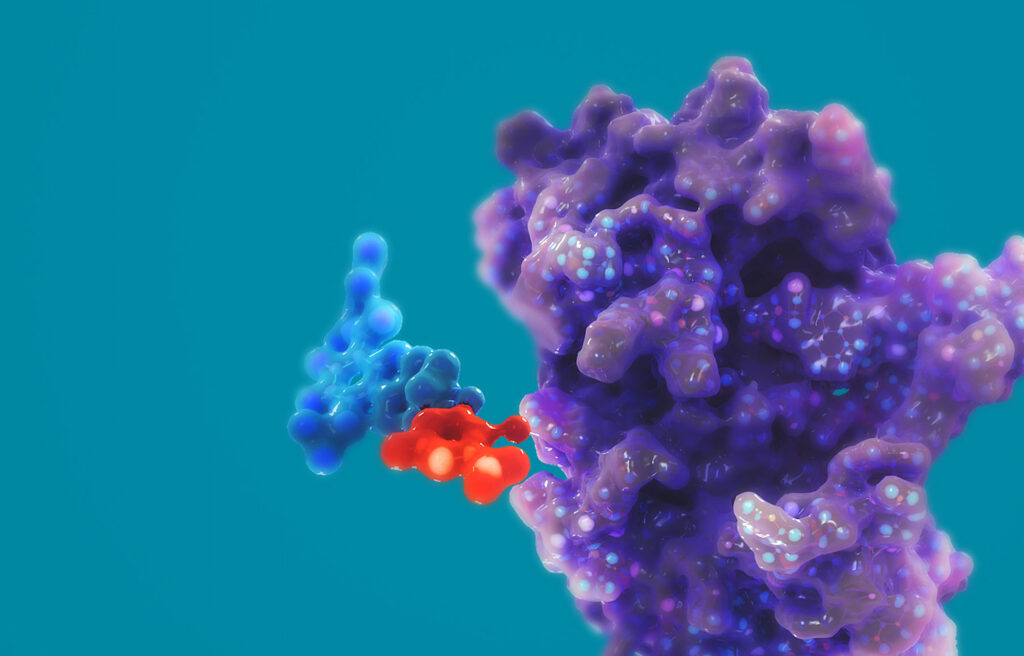
Ленакапавир — первый представитель совершенно нового класса антиретровирусных препаратов: он прикрепляется к капсиду, обволакивающему и защищающему вирусный геном, тем самым прерывая жизненный цикл ВИЧ. Исследователи пока не заметили признаков развития лекарственной устойчивости, но это, скорее всего, вопрос времени.
[su_spoiler class=»my-custom-spoiler» title=»МЕХАНИЗМ ДЕЙСТВИЯ ЛЕНАКАПАВИРА»] В состав каждого вириона ВИЧ-1 входит капсид — белковая оболочка, которая защищает две копии вирусной одноцепочечной РНК и ферментные белки. Жизненный цикл вируса зависит от функционирования капсида на этапах репликации, таких как опосредованный капсидом захват провирусной ДНК ядром клетки, сборка и высвобождение вируса, формирование капсидного ядра. Ленакапавир (lenacapavir, GS-6207) — первый представитель нового класса антиретровирусных препаратов, называемых ингибиторами капсида ВИЧ. Ленакапавир представляет собой селективный ингибитор капсидной функции ВИЧ-1. Ленакапавир, связываясь с межмолекулярным интерфейсом между N-концевым доменом одной субъединицы капсидного белка (p24) и C-концевым доменом соседней субъединицы в пределах одного капсидного гексамера, подавляет тройку указанных выше функций следующим образом: путем блокирования связывания белков ядерного импорта с капсидом, путем нарушения функционирования вирусных структурных полипротеинов Gag и Gag–Pol и снижения производства субъединиц капсидного белка, путем нарушения скорости объединения капсидных субъединиц, что приводит к деформации капсида [1] [2] [3] [4] [5] [6]. Итогом применения ленакапавира становится сдерживание репликации вируса.  Ленакапавир обладает противовирусной активностью, специфичной для ВИЧ-1 и ВИЧ-2; в отношении последнего активность снижена в 15–25 раз. На клеточных культурах активность ленакапавира подтверждена против всех групп ВИЧ-1 (M, N, O), включая подтипы A, A1, AE, AG, B, BF, C, D, E, F и G, — со значениями полумаксимальной эффективной концентрации (EC50) от 20 до 160 пмоль. In vitro ленакапавир характеризуется полной противовирусной активностью против мутантных штаммов ВИЧ-1, устойчивым к АРТ-препаратам четырех основных классов, включая нуклеозидные или нуклеотидные ингибиторы обратной транскриптазы (NRTI, NtRTI), ненуклеозидные ингибиторы обратной транскриптазы (NNRTI), ингибиторы переноса цепи интегразой (INSTI), ингибиторы протеазы (PI) [1] [7] [8]. Ленакапавир синергически (дополняя и усиливая) взаимодействует с указанными классами АРТ-препаратов и не обладает перекрестной резистентностью к другим АРТ-лекарствам, включая ингибиторы созревания. Благодаря пикомолярной активности ленакапавира, низкому клиренсу и медленной кинетике высвобождения одной подкожной инъекции препарата достаточно для сохранения его должной противовирусной активности на протяжении 6 месяцев. Это же справедливо в случае применения пероральной рецептуры ленакапавира один раз в неделю [1] [9] [10]. Молекулярный дизайн ленакапавира оказался сложнейшей задачей, поскольку итоговое соединение должно было эффективно и селективно воздействовать на капсидные функции ВИЧ, уметь противостоять метаболизирующим лекарственные препараты печеночным ферментам, располагать низким клиренсом и высокой потентностью. Структура соединения и его физико-химические свойства, включая 10 атомов фтора, высокую липофильность и низкую водную растворимость, получились весьма нетипичными, для того чтобы считаться характерными для «лекарственноподобного агента» [11].
Ленакапавир обладает противовирусной активностью, специфичной для ВИЧ-1 и ВИЧ-2; в отношении последнего активность снижена в 15–25 раз. На клеточных культурах активность ленакапавира подтверждена против всех групп ВИЧ-1 (M, N, O), включая подтипы A, A1, AE, AG, B, BF, C, D, E, F и G, — со значениями полумаксимальной эффективной концентрации (EC50) от 20 до 160 пмоль. In vitro ленакапавир характеризуется полной противовирусной активностью против мутантных штаммов ВИЧ-1, устойчивым к АРТ-препаратам четырех основных классов, включая нуклеозидные или нуклеотидные ингибиторы обратной транскриптазы (NRTI, NtRTI), ненуклеозидные ингибиторы обратной транскриптазы (NNRTI), ингибиторы переноса цепи интегразой (INSTI), ингибиторы протеазы (PI) [1] [7] [8]. Ленакапавир синергически (дополняя и усиливая) взаимодействует с указанными классами АРТ-препаратов и не обладает перекрестной резистентностью к другим АРТ-лекарствам, включая ингибиторы созревания. Благодаря пикомолярной активности ленакапавира, низкому клиренсу и медленной кинетике высвобождения одной подкожной инъекции препарата достаточно для сохранения его должной противовирусной активности на протяжении 6 месяцев. Это же справедливо в случае применения пероральной рецептуры ленакапавира один раз в неделю [1] [9] [10]. Молекулярный дизайн ленакапавира оказался сложнейшей задачей, поскольку итоговое соединение должно было эффективно и селективно воздействовать на капсидные функции ВИЧ, уметь противостоять метаболизирующим лекарственные препараты печеночным ферментам, располагать низким клиренсом и высокой потентностью. Структура соединения и его физико-химические свойства, включая 10 атомов фтора, высокую липофильность и низкую водную растворимость, получились весьма нетипичными, для того чтобы считаться характерными для «лекарственноподобного агента» [11].
[/su_spoiler]
«Когда люди перестают принимать ленакапавир, он в течение нескольких недель остается в организме в концентрации, достаточно низкой для того, чтобы вирус сумел выжить и адаптироваться. Если в период этого длинного фармакокинетического хвоста заразиться, это может привести к появлению лекарственно-устойчивого штамма ВИЧ».
Салим Абдул Карим (Salim Abdool Karim), директор Центра исследовательской программы по СПИДу в Южной Африке (Centre for the AIDS Programme of Research in South Africa, CAPRISA, Дурбан, США).
Опыт применения каботегравира (cabotegravir) длительного действия показал, что еще одним критическим этапом является начало приема препарата. Хотя у всех, кто начинает использовать этот препарат, должны быть отрицательные результаты проверки на ВИЧ, некоторые заражаются после первой инъекции. В период серонегативного окна вирус не обнаруживается, что приводит к медленно развивающейся инфекции, выявить которую затруднительно, а результаты анализов скачут между положительными и отрицательными.
«Устойчивые штаммы могут развиваться незаметно, пока вирусная нагрузка у пациентов слишком низкая для стандартного тестирования на резистентность, и лечение подобных случаев болезни очень сложное».
Сьюзан Эшлеман (Susan Eshleman), клинический патолог из Медицинской школы при Университете Джона Хопкинса (Johns Hopkins University, JHU, Балтимор, шт. Мэриленд, США).
Подобные случаи пропущенной инфекции, судя по всему, встречаются редко: в ходе PURPOSE 1 ретроспективно были выявлены 4 участницы с острой ВИЧ-инфекцией во время получения ленакапавира. После приема PrEP такие пациенты вряд ли смогут передать вирус, но вопрос с лечением будет становиться всё более важным по мере роста их числа.
Разработчики вакцин против ВИЧ размышляют, как скажется на их исследованиях столь прорывное достижение ленакапавира. Не исключено, отныне для клинической проверки любого вакцинного кандидата потребуются более чем убедительные данные, что экспериментальная прививка обеспечит очень хорошую защиту. Непонятен аспект с этичностью проведения исследований с подключением группы плацебо, когда уже есть PrEP-схема со 100-процентной защитой.
«Отныне любое исследование вакцины против ВИЧ должно учитывать ленакапавир. И это всё усложняет».
Беатрис Гринштейн (Beatriz Grinsztejn), глава клинических исследований из Фонда Освалду Круса (Fundação Oswaldo Cruz, Fiocruz, Рио-де-Жанейро, Бразилия), президент Международного общества борьбы со СПИДом (International AIDS Society, IAS, Женева, Швейцария).
VICTORIA CRUENTA. ПОБЕДА, КУПЛЕННАЯ КРОВЬЮ
В середине сентября 2024 года «Гилеад» уведомила об успешности клинического исследования PURPOSE 2 (NCT04925752) фазы III, которое оценило эффективность доконтактной профилактики ВИЧ-инфекции среди МСМ при помощи ленакапавира.
Испытание охватило взрослых (16 лет и старше) цисгендерных мужчин, трансгендерных мужчин, трансгендерных женщин и небинарных персон (n=3295), практикующих секс с мужчинами. Участникам назначали либо инъекционный подкожный ленакапавир каждые 6 месяцев, либо пероральный «Трувада» ежедневно.
Исследование должно было продолжаться 2 года, но было завершено досрочно ввиду того, что группа ленакапавира показала 99,9-процентную защиту от ВИЧ-инфицирования — против 99,2-процентной, которую организовала PrEP-схема в лице «Трувады» [1].
В группе ленакапавира зафиксированы 2 случая заражения на 2180 участников (заболеваемость 0,10 на 100 человеко-лет) — против зарегистрированных 9 случаев инфицирования среди 1087 испытуемых, получавших «Труваду» (заболеваемость 0,93 на 100 человеко-лет).
Получилось, что ленакапавир эффективнее «Трувады» на 89% (p=0,00245).
«Трудности, с которыми сталкиваются некоторые люди, принимающие пероральные таблетки каждый день, включая проблемы с приверженностью и стигматизацией, слишком долго препятствовали должному внедрению эпидемиологических мер, тем самым резко снижая влияние PrEP на профилактику ВИЧ. Невероятная эффективность ленакапавира, потенциальные преимущества очень редких инъекций и популяционное разнообразие участников напрямую свидетельствуют, какое влияние окажет этот препарат на сдерживание распространения ВИЧ во всём мире. Прорывной характер ленакапавира пополнил наш арсенал средств, позволяющих приблизиться к поколению людей, свободных от СПИДа».
Оньема Огбуагу (Onyema Ogbuagu), директор Йельской программы исследований противовирусных препаратов и вакцин (Yale Antivirals and Vaccines Research Program) при Медицинской школе Йельского университета (Yale University, Нью-Хейвен, шт. Коннектикут, США), ведущий исследователь PURPOSE 2.
PRETIUM LIBERTATIS. ЦЕНА СВОБОДЫ
«Гилеад» просит большие деньги за ленакапавир, применяемый в лечении ВИЧ с мультилекарственной устойчивостью. Так, жителям Норвегии «Санленка» обходится в $44,8 тыс. за годовой курс из двух подкожных инъекций, французы должны заплатить $44,5 тыс., американцам придется раскошелиться на $41,1 тыс., резиденты Израиля вынуждены отдавать $25,3 тыс.
Столь высокая стоимость вряд ли по карману государствам с недостаточно развитой экономикой, а ведь именно в таких странах распространенность ВИЧ выходит за все разумные пределы.
«Санленка»: ленакапавир для лечения ВИЧ-инфекции с множественной лекарственной устойчивостью
Ленакапавир примкнул к ибализумабу и фостемсавиру в борьбе с резистентным вирусом иммунодефицита человека.
Согласно оценочному анализу, выполненному в Ливерпульском университете, массовое производство ленакапавира может осуществляться по цене $94 в год на человека при условии ежегодного выпуска 1 млн доз. При расширении объемов производства до 10 млн доз в год, то есть при спросе со стороны 5 млн человек, цена снижается до $41 в год на одну персону. И всё это при сохранении 30-процентной маржи прибыли [1] [2].
Важное условие: для того чтобы ленакапавир подешевел в тысячу раз, «Гилеад» следует добровольно его лицензировать производителям генерических лекарств.
«Добровольная лицензия, охватывающая все страны с низким и средним уровнем дохода, открыла бы доступ к ленакапавиру для 83% населения мира, на которое приходится 95% случаев ВИЧ-инфекции. В противном случае государствам необходимо рассмотреть вопрос с выдачей принудительных лицензий, разрешающих выпуск копий запатентованных препаратов в условиях чрезвычайной ситуации в области здравоохранения».
Эндрю Хилл (Andrew Hill), научный сотрудник кафедры трансляционной медицины Ливерпульского университета (University of Liverpool, UOL, Ливерпуль, Великобритания) и член Комитета Всемирной организации здравоохранения (ВОЗ) по справедливому ценообразованию (WHO Fair Pricing Committee).
В начале октября 2024 года «Гилеад» оформила договоренности о добровольном лицензировании ленакапавира шести производителям генерических препаратов в целях распространения доступной по цене версии этого революционного средства доконтактной профилактики ВИЧ-инфекции среди жителей 120 стран [3].
Индийские «Д-р Редди’c лабораторис» (Dr. Reddy’s Laboratories), «Хетеро» (Hetero), «Эмкьюре фармасьютикалс» (Emcure Pharmaceuticals) и «Майлан» (Mylan) в составе «Виатрис» (Viatris), а также египетская «Ива фарма» (Eva Pharma) и пакистанская «Ферозсанс лабораториз» (Ferozsons Laboratories), получили право на выпуск дженерика ленакапавира для его реализации на территории государств с низким и доходом ниже среднего уровня (LMIC), согласно классификации Всемирного банка [4]. Зарабатывать на этом «Гилеад» не будет: никаких отчислений от реализации копии препарата не предусмотрено.
Неисключительная добровольная лицензия охватила многие государства Африки, Азии и Южной Америки — все те территории, которые больше всех страдают от эпидемии ВИЧ/СПИДа и на которые приходится приблизительно 70% мирового бремени инфекции [5].
Если говорить о пространстве бывшего СССР, недорогой ленакапавир появится в Азербайджане, Белоруссии, Грузии, Казахстане, Киргизии, Молдавии, Таджикистане, Туркмении, Узбекистане и на Украине.
Однако непатентованный ленакапавир, как и предполагалось, обошел стороной большинство стран со средним или высоким уровнем дохода, включая Бразилию, Колумбию, Мексику, Китай и Россию, на которые совокупно приходится где-то 20% случаев новых ВИЧ-инфекции. Здесь «Гилеад» собирается взимать по полной за PreP-схему, гарантирующую почти абсолютную защиту.
«Состоятельные люди, живущие в не особо богатых странах, не охваченных лицензией „Гилеад“, могут позволить себе брендовые препараты по любым ценам. Но подавляющее большинство населения не могут этого сделать, и именно они наиболее уязвимы к таким заболеваниям, как ВИЧ-инфекция. Мы по-прежнему наблюдаем неравенство в доступе, поскольку новые технологии доступны как для самых богатых, так и для самых бедных, — тогда как тем, кто находится посередине, приходится бороться за них».
Отоман Меллук (Othoman Mellouk), руководитель программы по интеллектуальной собственности и доступу к лекарствам Международной коалиции по готовности к лечению (International Treatment Preparedness Coalition, ITPC, Йоханнесбург, ЮАР).
В лицензионных условиях «Гилеад» нет ничего удивительного: ранее подобные соглашения, касающиеся недорогих препаратов-копий против рака, гепатита, ковида и ВИЧ, но при этом вычеркивающие множество стран, заключались неоднократно. И было бы слишком оптимистичным полагать, что фармкомпания из Фостер-Сити откажется зарабатывать, когда на подобные лекарства есть большой спрос.
«Лицензионная сделка „Гилеад“ отказала некоторым странам, которые больше всего выиграли бы от широкого и быстрого доступа к ленакапавиру. За бортом остались те страны, где ВИЧ распространяется среди маргинализированных групп, таких как мигранты, работники секс-бизнеса и потребители инъекционных наркотиков, до которых, скорее всего, можно достучаться через системы общественного здравоохранения. Именно эти люди являются центром притяжения и движущей силой эпидемии, которую нужно остановить».
Мелисса Барбер (Melissa Barber), исследователь из Сотрудничества по регуляторной строгости, целостности и прозрачности (Collaboration for Regulatory Rigor, Integrity, and Transparency, CRRIT) при Медицинской школе Йельского университета (Yale University, Нью-Хейвен, шт. Коннектикут, США).
Согласно условиям неисключительного добровольного лицензирования, производителям генерических копий ленакапавира запрещено экспортировать его в страны, не охваченные соглашением. К примеру, государственная система Бразилии не сможет закупать дешевый вариант препарата в Индии, где он будет выпускаться.
Разумеется, у любой страны, если вдруг она сочтет распространение ВИЧ угрозой национальным интересам, есть право принудительного лицензирования ленакапавира в обход интеллектуальной собственности «Гилеад», получившей патент на это лекарство. Но даже тогда индийские поставщики не смогут продать его той же Бразилии.
«Драконовские условия „Гилеад“ не оставляют выбора: бразильские ученые должны осуществить обратную разработку (реверс-инжиниринг) ленакапавира и наладить его локальное производство. И мы это сделаем. Однако это займет слишком много времени — того времени, когда мы могли бы спасти большое количество жизней. В целом Бразилия годами остается в стороне от всех таких лекарственных лицензионных сделок, и за это приходится расплачиваться одной четвертой части населения, живущей за чертой бедности. Мы — огромная страна с государственной системой здравоохранения, ужасающим неравенством и множеством уязвимых людей».
Сузана ван дер Плуг (Susana van der Ploeg), юрист рабочей группы по интеллектуальной собственности Бразильской междисциплинарной ассоциации по СПИДу (Associação Brasileira Interdisciplinar de AIDS, ABIA, Рио-де-Жанейро, Бразилия).
Разумеется, цена ленакапавира в Бразилии окажется много ниже его непомерной цены в США, но всё равно совокупная стоимость будет гораздо выше той, которую готово заплатить государство. «Гилеад» известны и понятны все подобные опасения, вот почему она, если верить заявлениям самой фармкомпании, «изучает несколько инновационных стратегий, включая многоуровневое ценообразование», чтобы сделать препарат доступным в Латинской Америке.
«Для того чтобы ленакапавир принес реальную пользу в профилактике и лечении ВИЧ-инфекции, он должен быть недорогим и доступным для абсолютно всех людей, кто в нем нуждается. Активисты уже несколько месяцев пытаются заставить „Гилеад“ лицензировать генерический ленакапавир Патентному фонду ЮНИТЭЙД (Medicines Patent Pool), поддерживаемому ООН, но фармкомпания решила лицензировать его на своих условиях — и даже не объявила цену».
Мохга Камал-Янни (Mohga Kamal-Yanni), соруководитель политики Народного альянса по лекарственным средствам (People’s Medicines Alliance, PMA).
IN LUCRO ANIMUS SOLUS. РАЧИТЕЛЬНЫЙ БИЗНЕС
Если по каким-то досужим причинам кто-то считает, что основной смысл существования какой-либо фармацевтической компании заключен в лечении и профилактике заболеваний, он ошибается. Глубоко и полностью.
Более того, категорически странно воспринимать какую-либо фармкомпанию как нечто абстрактное, виртуальное и ограниченное добрыми и обнадеживающими вестями, поступающими из ее пиар-отдела. Никогда не следует забывать, что за любым предприятием стоят конкретные люди — будь то учредители, инвесторы или акционеры. И они хотят зарабатывать, причем с каждым разом быстрее и больше. Главная забота и венец концепции и сути любого бизнеса — бесконечный рост прибыли и максимальное снижение расходов. Всё остальное асимптотически стремится к нулю.
Работающая с 1987 года «Гилеад» этого, к ее чести, никогда не скрывала. На корпоративном сайте десятилетиями декларировалась следующая сентенция [1] [2] [3]:
- Миссия «Гилеад»: открывать, разрабатывать и коммерциализировать инновационные лекарственные препараты, ориентирующиеся на области с неудовлетворенной медицинской потребностью и предназначенные для улучшения медицинской помощи пациентами.
Летом 2020 года риторика поменялась [4]:
- Миссия «Гилеад»: открывать, разрабатывать и предоставлять инновационные лекарственные препараты людям с жизнеугрожающими заболеваниями.
Всякий бизнес ставит собственные интересы на первое место. Измененная под влиянием какого-либо тяжелого или хронического заболевания оценочность суждений пациентов и их близких приводит к исчезновению критического мышления в отношении фармацевтических компаний. Да, они самым непосредственным образом занимаются и напрямую работают с драгоценнейшим, что есть в жизни каждого человека, — его здоровьем. Но сие сокровище исключительно персонализировано, будучи важным только для конкретного индивида. Бизнес же к этому испытывает лютый холод и непреложное спокойствие. Помните: здоровье — не более чем точка приложения и специфика деловых практик фармацевтической отрасли. И ключ к пониманию ситуации состоит в том, чтобы без обиняков это признавать.
Разумеется, это ни в коем случае не означает, что за маской добродетели фармацевтического бизнеса таится не знающий снисхождения монстр. Нет, бизнес всего лишь прилежно и рачительно заботится о себе — читай, о благосостоянии владельцев и всех причастных. И делает это старательно, усердно и местами ретиво.
Достаточно вспомнить, что, когда в декабре 2013 года свет увидел софосбувир (sofosbuvir), один грамм которого обходился в 50 раз дороже одного грамма золота, приходилось платить $84 тыс. за 12-недельный курс лечения. «Гилеад» выставила высокую цену, но и «Совальди» (Sovaldi) в ряде случаев гарантированно излечивал хронический вирусный гепатит C, под бременем которого находилось до 170 млн человек. В период 2013–2022 гг. софосбувир заработал $68 млрд.

Лекарства по цене золота: дорогостоящие препараты не способствуют инновациям
Цена лекарств постоянно растет, несмотря на отсутствие значимых улучшений. Разбираемся, почему фармацевтическая индустрия превратилась в машину для выкачивания денег.
Поучителен бизнес-кейс тенофовира (tenofovir), который появился в августе 2004 года, став одним из краеугольных лекарственных средств в схемах антиретровирусной терапии ВИЧ-инфекции. Во-первых, «Гилеад», как следует из судебных разбирательств [5] [6], придержала появление на рынке его усовершенствованной и более безопасной версии в лице тенофовира алафенамида фумарата (tenofovir alafenamide fumarate; TAF), тем самым максимизируя прибыль от продаж оригинального тенофовира дизопроксила фумарата (tenofovir disoproxil fumarate; TDF). Во-вторых, долгие годы в подвешенном состоянии остаются патентные вопросы: кому по сути принадлежат права на интеллектуальную собственность, связанную с тенофовиром, — правительству США или «Гилеад» [7]. Без оглядки на ряд незакрытых проблем «Трувада» доказанно является высокоэффективным способом доконтактной профилактики ВИЧ-инфекции, схема которой начала внедряться с июля 2012 года. В период 2004–2023 гг. реализация тенофовира достигла $41 млрд.
Свежа история с ремдесивиром (remdesivir), который, дебютировав в мае 2020 года, стал настоящим спасением во время разрушительной пандемии коронавирусной инфекции COVID-19. В США за 5 дней лечения препаратом «Веклури» (Veklury) надо было отдать $3120, а в экономически развитых странах — заплатить $2340. Для справки: себестоимость производства пятидневного терапевтического курса ремдесивиром не превышает $10. В период 2020–2023 гг. продажи ремдесивира составили $14,5 млрд.
Давно выбранный деловой курс «Гилеад» непоколебим: она поставляет противовирусные препараты по полной стоимости в страны с высоким, выше среднего и средним уровнем дохода. И только небогатые или уж совсем бедные государства получают право лечить людей легальными и недорогими дженериками.
Примеры софосбувира, тенофовира и ремдесивира более чем показательны и достойно отражают давно сложившуюся ситуацию, когда здравый смысл попросту меркнет, отказывая себе в торжестве над совокупностью недостойных факторов, как то: отсутствие национальных стратегий борьбы со смертоносными заболеваниями, нежелание выделять крупное финансирование для полного избавления населения от жизнеугрожающих вирусных инфекций, нехватка политической воли на принудительное лицензирование и, наконец, непомерно высокая стоимость лечения и профилактики.
Так что дело за Большими Братьями и Большими Сестрами по всему миру, которые должны определиться, нужен ли их верноподданным и налогоплательщикам ленакапавир или как-нибудь обойдутся тем, что есть.
Как бы то ни было, «Гилеад» — безусловно, великая фармацевтическая компания, владеющая столь нужными человечеству лекарствами.
LONGUM ITER. ДОЛГАЯ ДОРОГА
На протяжении большей части своей карьеры в «Гилеад» химик-фармацевт Уинстон Це (Winston Tse) жил и дышал исключительно одним делом. В то время как его коллеги из других фармкомпаний переходили от проекта к проекту, Це провел целое десятилетие, одержимый единственной целью — капсидом ВИЧ.
Капсид ВИЧ — сложная, богатая белками оболочка, которая защищает генетический код, который вирус пытается пронести в клетки организма-хозяина. Це нужно было придумать малую молекулу, способную нарушать функции этой оболочки, тем самым не давая вирусу реплицироваться.
Долгие годы упорного труда позади: капсидный ингибитор ленакапавир одобрен для лечения мультирезистентной ВИЧ-инфекции и готовится к расширению спектра показаний, став воистину революционным средством доконтактной профилактики ВИЧ-инфекции.
ELUSIVA META. НЕУЛОВИМАЯ МИШЕНЬ
В период с середины 1990-х гг. до середины 2000-х гг. химики добились больших успехов в создании лекарств, сдерживающих и подавляющих вирус иммунодефицита человека: главным образом путем блокирования его ферментов. Антиретровирусные препараты, разнесенные на шесть классов по механизму действия, ингибируют один из этапов цикла репликации ВИЧ, как то: проникновение вируса, обратную транскрипцию, интеграцию вирусной ДНК, протеолиз вирусных полипротеинов. Но вирус наделен хитроумной способностью находить обходные пути, избегая лекарственного прицела, что заставляло исследователей постоянно изобретать новые и более совершенные молекулы и их комбинации.
В поисках мишеней для борьбы с лекарственной резистентностью был выбран капсид ВИЧ. Помимо своей очевидной привлекательности (он является критически важным щитом для генетического кода вируса), таргетирование на капсид решает проблему лекарственной устойчивости, которая явно мешает надежной терапии ВИЧ-инфекции.
«Область вирусного генома, кодирующая капсидный белок, относится к числу самых неизменных и консервативных участков. Нацеленное на него лекарство будет, скорее всего, очень долго избегать проблем с резистентностью».
Кристофер Эйкен (Christopher Aiken), вирусолог из Вандербильтского университета (Vanderbilt University, Нашвилл, шт. Теннесси, США).
Когда «Гилеад» запустила проект, о капсиде, состоящем из 1,5 тыс. белков, которые объединяются в гексамеры и пентамеры, образуя оболочку в форме баклажана, было известно совсем немногое. У исследователей не было крупных планов всего капсида, а в кристаллической структуре был запечатлен только мономерный белок.
Ученые также не знали и до сих пор слабо представляют, как именно собирается капсид. Умозрительно процесс напоминает молекулярное вязание, которое начинается на конце «стебля баклажана» и становится всё шире по мере добавления рядов гексамеров. Совершенно ясно одно: все эти полторы тысячи белков как-то должны быть связаны друг с другом, придерживаясь правильной геометрии и кинетики.
«В том, как геометрически структурирована эта система, есть особая прелесть».
Томаш Цигларж (Tomáš Cihlář), старший вице-президент по вирусологическим исследованиям «Гилеад сайенсиз» (Gilead Sciences).
Капсидная оболочка должна быть достаточно стабильной, чтобы собираться вместе во время созревания вируса, но при этом легко разбираться, чтобы обнажать генетический груз, когда он окажется внутри клетки-хозяина. Это приводит к «хрупкому равновесию всей капсидной оболочки, которое, как мы думали, может стать ее ахиллесовой пятой», — поясняет Цигларж, задумавший капсидную программу еще в 2006 году.
Помимо ограниченной структурной информации об оболочке, исследователи не знали ни одной такой молекулы, которая могла бы убедительно связываться с капсидным белком. Единственными подсказками в научной литературе были «некоторые по-настоящему плохие, реактивные малые молекулы с катастрофически низкой потентностью», — вспоминает Цигларж. — «В конечном итоге мы усомнились в селективности этих соединений».
Осуществленный «Гилеад» высокопроизводительный скрининг не дал никаких многообещающих результатов. Когда в 2008 году Це и еще один химик-фармацевт присоединились к проекту, перед ними был по сути чистый холст для творчества.
Предстояла сверхзадача: разработчики не пытались блокировать какой-то отдельный белок, как это обычно делают большинство низкомолекулярных препаратов. Нет, они искали соединение, которое могло бы вклиниться между соседними капсидными белками в составе похожих на колесики гексамеров, которые собираются в более крупную оболочку. «Трудно представить, каким образом можно нарушить этот процесс de novo», — сетует Це.
По сути лекарственные разработчики действовали вслепую: они бесконечно смешивали малые молекулы с очищенными капсидными белками, а затем, обращаясь к биохимическому скринингу, пытались отыскать те соединения, которые либо ускоряли, либо замедляли спонтанную сборку белковых комплексов. Весь процесс приходилось просчитывать до мельчайших подробностей — на атомном уровне, ведь даже небольшое нарушение хрупкого баланса взаимодействий между капсидными и клеточными белками могло иметь катастрофические для вируса последствия.
Лекарственные мишени были очевидны: нужны те области капсида, которые важны для его структурной стабильности. Если направить на них подходящие низкомолекулярные соединения, это результирует тем, что, к примеру, капсид откроется в неподходящее время или в неподходящем месте, и клетка переварит вирусные компоненты; или, наоборот, капсид заблокируется и не откроется, то есть никогда не высвободит свой груз нуклеиновой кислоты.
При любом раскладе было необходимо продемонстрировать, что найденное соединение, связанное с соседними капсидами, блокирует, пусть даже слабо, репликацию вируса. Задача оказалась настолько сложной, а ожидания такими низкими, что руководитель Це хотел увидеть хотя бы субмикромолярную активность (большинство лекарственных препаратов обладают наномолярной активностью), — и это считалось бы победой.
В 2009 году случился научный прорыв: академические исследователи из Научно-исследовательского института Скриппса (The Scripps Research Institute, TSRI, Ла-Холья, Сан-Диего, шт. Калифорния, США) и Виргинского университета (University of Virginia, UVA, Шарлотсвилл, шт. Виргиния, США) опубликовали рентгеновскую структуру капсидного гексамера, что позволило лекарственным разработчикам впервые взглянуть на взаимодействие белковых единиц [1]. В 2011 году они еще тщательнее уточнили структуру капсида и ее особенности [2].

В 2010 году «Пфайзер» (Pfizer) поделилась кристаллической структурой ингибитора, достоверно связывающегося с капсидом в той области, посредством которой вирус взаимодействует с определенным клеточным белком человека, CPSF6, помогающим ему нацеливаться на активные участки генома, тем самым увеличивая патогенность. Молекула, будучи производным индола, не дестабилизировала капсидную броню, как можно было бы предположить, а, скорее, стабилизировала, не давая ей легко раскрываться, что, впрочем, не менее успешно прерывало весь процесс. (Хотя молекулы, дестабилизирующие капсид, «Пфайзер» тоже придумала.) Итоговая эффективность соединения оказалась совсем скромной, и в клиническую разработку оно не отправилось [3] [4] [5] [6].
PROFECTUS DENIQUE. НАКОНЕЦ-ТО ПРОГРЕСС
Продемонстрированное «Пфайзер» соединение «серьезно изменило наш подход к химии», — возвращается в прошлое Цигларж. Взяв этот хит за отправную точку, химики-фармацевты «Гилеад» быстро придумали перспективный структурный остов для своей молекулы.
Затем наступило самое неприятное и мучительное: улучшение молярной активности (потентности) и стабильности молекулы. Первые соединения почти мгновенно метаболизировались в печени.
Команде Це потребовалось долгих шесть лет, в ходе которых они сконструировали приблизительно 4 тыс. молекул, чтобы добраться до пригодного препарата-кандидата. За это время соединение прилично разрослось, поскольку изобретатели пытались придумать нечто, что могло бы перекрывать значительный по протяженности промежуток (интерфейс) между двумя капсидными белками в гексамере.
«Мы применили абсолютно все приемы из нашего богатого арсенала», — Це указывает на перенасыщение атомами фтора в молекуле. — «Я твердо убежден, что каждый атом в ней играет свою определяющую роль».
За годы, которые разработчики потратили на оптимизацию капсидного ингибитора, в «Гилеад» появились критики, недовольные бесконечной тратой ресурсов без видимой отдачи. В какой-то момент старший менеджер заявил руководству исследовательского отдела, что невозможно объединить все необходимые фармакологические свойства в одной молекуле. Он напомнил Це, что его команда несколько раз просила «еще шесть месяцев» для работы над проблемой.
Спустя неделю напряженных дискуссий Це всё же смог показать руководителю данные, доказывающие, что его команда создала вожделенную молекулу.
И она (GS-CA1) получилась более чем необычной. Только посмотрите на нее: восемь (!) атомов фтора, сульфонил и сульфаниламид, ацетилен, хирально соединенный циклопропан… — явно гибридный плод любви нескольких тысяч предшествовавших соединений.

Так, индольное ядро (слева) оригинальной молекулы «Пфайзер» (PF-3450074) превратилось в более сложную кольцевую систему из пиразола и циклопропана, нагруженных четырьмя атомами фтора. Амидная цепь уксусной кислоты, от него отходящая, вместе с разветвлением на две арильных группы, в целом сохранилась, хотя и в несколько иной форме (выделена цветом).
В GS-CA1 были введены дополнительные функциональные группы: метилсульфонильная (слева внизу), циклопропилсульфаниламидная (справа внизу), атом хлора в составе ароматического кольца (справа). Появились еще четыре атома фтора: добавлены к фенильному кольцу (сверху) и в виде дифторметильной группы (внизу) — всего восемь.
Внушительная молекулярная масса (958,3 г/моль) и комплексная структура GS-CA1 привели к должному изменению свойств, включая растворимость, липофильность, мембранную проницаемость, типы взаимодействия с белком-мишенью и прочность связывания, метаболическую стабильность и период полувыведения.
Наиболее выдающейся особенностью молекулы-франкенштейна «Гилеад» была ее активность в пикомолярном (!) диапазоне. Цигларж был в восторге: «О, это нечто особенное! Ни один из других препаратов против ВИЧ даже близко не приближается по фармакологической активности к нашему соединению».
«Всем понятна привлекательность правила пяти. Но кому они нужны? Противогепатитные ледипасвир (ledipasvir), велпатасвир (velpatasvir) и воксилапревир (voxilaprevir) — ничто из этого ему не следуют. Правила дают простые ответы, но в открытии лекарств простых ответов не бывает. Правила ограничивают творчество».
Джон Линк (John Link), вице-президент по лекарственной химии «Гилеад сайенсиз» (Gilead Sciences) в период 2006–2020 гг.
Новаторская молекула «Гилеад», нарушающаяся функции капсида, препятствует сборке капсида и вмешивается в его разборку, тем самым блокируя репликацию вируса на разных этапах. Она действует как до попадания вирусной частицы в клетку-хозяина, так и после.
К примеру, молекула, эксплуатируя электростатические взаимодействия и водородные связи, модифицирует нормальный процесс сборки ВИЧ-капсида и его взаимодействия с клеткой. Соединение способствует связыванию отдельных белковых компонентов во время сборки, а затем связывается с мультимерами, которые соединяются, образуя капсид, и стабилизирует их. В совокупности это приводит к ускорению формирования капсидов, которые получаются неправильными, неспособными к репликации.
«Даже если ВИЧ заразит клетку, молекула замедлит разборку капсида и прервет другие функции, от него зависящие, что приведет к остановке создания новых копий вируса. Исследования биологии капсида ВИЧ продолжают открывать всё новые интереснейшие его роли почти на каждом этапе цикла вирусной репликации».
Стивен Янт (Stephen Yant), старший директор по биологии «Гилеад сайенсиз» (Gilead Sciences).
Всё бы ничего, но была серьезная загвоздка: ингибитор капсида обладал категорически плохой растворимостью (<1 мкг/мл) — словно камень. Это означало, что его придется назначать в виде инъекций, что совсем нежелательно с практической точки зрения, учитывая, сколько прекрасных каждодневных таблеток против ВИЧ уже выпущено.
Опять же, за 12 лет, минувших с момента запуска программы капсидного ингибитора, лечение ВИЧ-инфекции стало куда более совершенным, в том числе благодаря препаратам самой «Гилеад». Так что большинство людей вполне могли обходиться присутствующим на рынке лекарственным набором.
FORTUNA IMPROVISA. НЕОЖИДАННАЯ УДАЧА
Эволюция антиретровирусной терапии ВИЧ-инфекции привела к однозначному пониманию того, что нужны совершенно новые препараты, которые, располагая гарантированно сопоставимой с существующими лекарствами безопасностью и эффективностью, либо обеспечивают функциональное излечение, либо предоставляют повышенное удобство своего применения.
Бизнесмены от фармкомпаний, весьма заинтересованные в ВИЧ-инфекции как хроническом заболевании, по сути «подсаживающем» пациентов на пожизненное лечение, продавливали через лидеров общественного мнения мысль о том, что было бы неплохо рассмотреть вариант терапии препаратами длительного действия.
Шел 2017 год, и такой подход всё чаще транслировался: мол, ежедневный прием таблеток обременителен и чреват риском пропуска очередной, но по-прежнему жизненно необходимой дозы, да и каждодневное напоминание о положительном ВИЧ-статусе психологически переносится нелегко. К этому добавлялись бесконечные убедительные данные о том, как недостаточно хорошо люди придерживаются терапии или профилактики — а всё из-за таблеток, которые надо пить со строгой регулярностью.
Другими словами, к тому времени, когда «Гилеад» добралась до стабильного и мощного лекарственного соединения, его плохая растворимость уже не была проблемой, а, напротив, стала преимуществом. «Честно признаться, мы никогда не позиционировали наш капсидный ингибитор инъекционным препаратом длительного действия», — раскрывает секреты Це.
А тут еще не знающие устали конкуренты. Осенью 2016 года главный соперник в лице «Виив хелскеа» (ViiV Healthcare) запустил регистрационную фазу III клинического испытания лекарственной комбинации с пролонгированным высвобождением из каботегравира (cabotegravir) и рилпивирина (rilpivirine). Предприятие, за которым стояла «ГлаксоСмитКляйн» (GlaxoSmithKline), верило в успех вводимого раз в месяц препарата, который, судя по результатам фазы II клинической проверки, обеспечивал лучший контроль над вирусной нагрузкой в сравнении с привычными пероральными медикаментами [7]. Более того, «Виив» вынашивала большие планы на использование каботегравира длительного действия раз в два месяца для профилактики заражения ВИЧ.
Цигларж нервничал: разработка лекарственного дуплета «Виив» опережает усилия его компании на голову, хотя успокаивал тот факт, что внутримышечные инъекции несут дополнительную сложность для пациента, требуя от него визитов к врачу. «Мы хотели избавиться от досаждающих ограничений, сделав менее частые и более простые в применении инъекции. Разумной, но амбициозной целью представлялось подкожное дозирование один раз в три месяца».
«Гилеад» осознавала всю мощь фармацевтической машины «Виив», и поэтому сразу повысила планку требований: капсидный ингибитор должен вводиться как можно реже. Никто бы не распознал в этом никакого подвоха или чистой воды маркетингового хода, призванного угробить всех конкурентов, ведь чрезвычайная редкость дозирования несет сплошные преимущества для потребителя.
SIC ITUR AD ASTRA. ЗВЕЗДНЫЙ ПУТЬ
Итоговая молекула ленакапавира (GS-6207, GS-CA2) почти не отличается от предшествовавшей GS-CA1. Ну разве что циклопропан чуть иначе прикреплен к пиразольному кольцу, циклопропановый мотив на сульфониламидной группе уступил место метильной группе, добавились два атома фтора. Введенные модификации (слегка увеличившие молекулярную массу до 968,3 г/моль) были призваны оптимизировать лекарственные свойства, улучшить метаболическую стабильность, повысить аффинность связывания, продлить период полувыведения, улучшить свойства биораспределения.

Так, например, определенным стратегическим образом расположенные фторированные функциональные группы используются для тонкой настройки конформации молекулы, ее способности преодолевать клеточные мембраны, регулирования активности и многого другого [8]. В частности, трифторметильные группы (CF3) — расхожий инструмент для корректировки липофильности и метаболической стабильности молекулы. Десять атомов фтора, включая две группы CF3, в структуре ленакапавира — именно они, скорее всего, позволяют ему сохранять свое терапевтическое и профилактическое действие на протяжении 6 месяцев.
«В медицинской химии фтор в какой-то степени считается своего рода волшебством. У него сильные электроноакцепторные свойства, но при этом он очень мал, поэтому способен изменять электронные свойства и конформацию молекулы, не сильно влияя на ее общий размер. Связь углерода со фтором удивительно прочна. Вполне возможно, что мы стали перебарщивать с использованием фтора в наших молекулах. Сейчас его можно найти в каждой пятой малой молекуле. Но эти атомы внедряются не случайно: с ними легко добиваться нужных свойств».
Николас Минвелл (Nicholas Meanwell), до 2022 года работавший вице-президентом по науке и руководителем отдела химии противовирусных препаратов «Бристол-Майерс Сквибб» (Bristol-Myers Squibb), которой отдал 40 лет своего труда.
Если бы не суперидея продвижения капсидного ингибитора в качестве препарата длительного действия, проект, скорее всего, был бы похоронен. И правда: всё шло к расхожему сценарию, когда над молекулой трудятся долго, упорно, с большим мастерством и решимостью, чтобы по итогам создать нечто, полностью устаревшее к моменту окончательной готовности. Разумеется, мы никогда не узнаем, когда в «Гилеад» приняли решение переключиться с просто ингибитора капсида как нового класса антиретровирусных препаратов на новаторское лекарство с пролонгированным высвобождением.
Терпение компании из Фостер-Сити достойно восхищения: совершенно безумное с точки зрения структурной компоновки и насыщенности соединение, разработка которого подпитывалась на протяжении бесконечных 12 лет.
В любом случае «Гилеад» невероятно подфартило: история ленакапавира — история проекта, который мог бы обернуться пустой тратой внушительных ресурсов, даже если бы увенчался успехом.
Уместно провести аналогию со старым научно-фантастическим рассказом Альфреда ван Вогта «Далекий Центавр», в котором экспедиция, будучи погруженной в гибернацию, отправляется в 500-летнее путешествие к Альфе Центавра. По прибытию к точке назначения команда обнаруживает, что вся система давно заселена земными колонистами: благодаря открытию сверхсветового двигателя, позволявшего добираться всего за три часа.
В контексте временного масштаба разработку любого лекарства сопровождает риск оказаться устаревшим. Конкуренты, пациенты и подходы к ценообразованию — всё это может существенно измениться и стать иным к тому времени, когда вы прибудете к точке назначения.
Уинстон Це, отдавший «Гилеад» пятнадцать лет, затем перешел на работу в «Вир байотекнолоджи» (Vir Biotechnology), которая поставила перед собой наисложнейшую задачу: найти способ вылечить вирусные гепатиты B и D. С февраля 2024 года Це трудится в биотехнологическом стартапе «Мейз терапьютикс» (Maze Therapeutics), где занимает должность старшего вице-президента по разработке лекарств [9].
Томаш Цигларж, постдокторантом пришедший в «Гилеад» еще в 1994 году, так и продолжает в ней работать уже долгих 30 лет, придумывая, сидя в кресле старшего вице-президента по научно-исследовательской работе в области вирусологии, всё новые противовирусные препараты. Так, например, он принимал непосредственное участие в создании противоковидного ремдесивира (remdesivir) [10].
Тем временем «Гилеад» изучает инъекционное сочетание ленакапавира с теропавимабом (teropavimab; TAB) и зинлирвимабом (zinlirvimab; ZAB), моноклональными антителами широкого спектра действия. Комбинация, назначаемая каждые 6 месяцев, ориентирована на терапию ВИЧ-инфекции.
Два укола в год для лечения ВИЧ
Терапия ВИЧ-инфекции инъекциями каждые шесть месяцев.
В планах «Гилеад» также стоит выпуск ленакапавира в пероральном исполнении: рецептура позволит объединить его с биктегравиром (bictegravir) или ислатравиром (islatravir) — соответственно для ежедневной или еженедельной терапии ВИЧ-инфекции. Коммерческий запуск комбинаций намечен на 2027 год.

Биктегравир + ленакапавир: одна каждодневная таблетка для лечения ВИЧ
Gilead Sciences разработала новую ежедневную АРТ-схему из двух препаратов.
Лечение ВИЧ одной таблеткой один раз в неделю
Ленакапавир и ислатравир, назначаемые каждые 7 дней, не хуже, чем «Биктарви», применяемый каждый день.

IN SPE. ВАКЦИННАЯ СМЕРТЬ
Несмотря на впечатляющие успехи в разработке PrEP-препаратов, люди должны продолжать принимать их, пока остаются в группе риска, а это может быть вся жизнь. Очевидным решением была бы гораздо более дешевая вакцина, вводимая, к примеру, до полового созревания и способная обеспечить многолетнюю защиту. Эту исследовательскую головоломку вот уже более двух десятилетий не удается решить ведущим ученым в правительстве, академических кругах и промышленности.
«Пока не будет найдено излечивающее лекарство или надежная вакцина, нам придется поддерживать меры в ответ на СПИД и после 2030 года во всех уголках мира».
Винни Бьяньима (Winnie Byanyima), исполнительный директор Объединенной программы Организации Объединенных Наций по ВИЧ/СПИДу (ЮНЭЙДС) [Joint United Nations Programme on HIV and AIDS, UNAIDS, Женева, Швейцария].
Хотя с 2000 года государства, некоммерческие организации и фармацевтические компании потратили на разработку вакцин против ВИЧ свыше $18 млрд, ни одно клиническое испытание так и не вышло за пределы фазы III.
Среди недавних громких провалов: прекращение в январе 2023 года клинической проверки мозаичной вакцины авторства «Джонсон энд Джонсон» (Johnson & Johnson), сочетающей четырех- и двухвалентные иммуногены в виде белковых компонентов ВИЧ [1], и досрочная остановка в декабре 2023-го клинического исследования созданной в Угандийском научно-исследовательском институте вирусов (Uganda Virus Research Institute, UVRI, Энтеббе, Уганда) комбинированной вакцины, сочетающей непосредственно белковые компоненты ВИЧ с их кодированным представлением в ДНК и вирусе осповакцины [2].
Все неудачные вакцинные проекты столкнулись с отсутствием должной эффективности.
В организме человека, не получающего лечения, ВИЧ ежедневно генерирует 10 млрд новых вирусных частиц. Да, антиретровирусные препараты творят чудеса в профилактике и терапии, однако подавляющему большинству людей необходимо принимать их пожизненно, иначе вирус начнет активно размножаться.
«Разработка вакцины, которая помогла бы организму вырабатывать собственный активный иммунный ответ, чтобы держать вирус в узде, — святой Грааль профилактики ВИЧ».
Джим Кублин (Jim Kublin), исполнительный директор Сети клинических испытаний вакцин против ВИЧ (HIV Vaccine Trials Network, HVTN) при Онкологическом центре Фреда Хатча (Fred Hutchinson Cancer Center, Сиэтл, шт. Вашингтон, США).
Мечтой было бы иметь вакцину, которая защищала бы человека на протяжении многих лет — как те, что защищают от столбняка или оспы, — или, что еще лучше, на всю жизнь, как вакцина против кори.
«Результаты применения ленакапавира резко повысили планку для любых будущих вакцин против ВИЧ, которым придется продемонстрировать такой же высокий показатель защитной эффективности, действовать гораздо дольше и стоить существенно дешевле».
Митчелл Уоррен (Mitchell Warren), исполнительный директор Целевой группы по разработке вакцины против СПИДа (AIDS Vaccine Advocacy Coalition, AVAC, Нью-Йорк, США).
У ВИЧ есть несколько ключевых особенностей, которые сводятся к одному и тому же принципу: он очень ловкий уклонист, который постоянно меняется и использует приманки, чтобы избежать поимки иммунной системой. Стандартный вакцинный подход предполагает введение в организм инактивированного вируса или его части, чтобы иммунная система могла заранее подготовить ответ на инфекцию, еще до вторжения. Но ВИЧ прибегает к разнообразным трюкам, которые делают невероятно сложным для организма даже распознать его как захватчика, не говоря уже о том, что он заражает непосредственно те самые клетки, которые отвечают за запуск ответной иммунной реакции.
Для сравнения возьмем коронавирус SARS-CoV-2, породивший пандемию COVID-19. Его название происходит от латинского слова «корона». Потому что при попадании в организм он подобен великолепной диадеме, усыпанной бриллиантами, где каждый драгоценный камень — это шипообразный белок, сигнализирующий организму о проникновении вируса. ВИЧ же представляет собой простую металлическую корону с горсткой бриллиантов, разбросанных в отдалении друг от друга, притом что некоторые из них — ложные для иммунной системы мишени. Это не только препятствует распознаванию вируса, но и действует как своего рода броня, препятствующая прикреплению антител.
ВИЧ мутирует с чрезвычайно высокой скоростью, поэтому даже если организм успевает обнаружить чужака, к тому времени, как начнется выработка иммунного ответа, вирус уже успевает сменить маскировку.
«Он постоянно эволюционирует, принося в жертву то, чем был раньше, чтобы очень и очень быстро приспособиться к окружающей среде».
Кэтрин Бар (Katharine Bar), врач-инфекционист и адъюнкт-профессор Пенсильванского университета (University of Pennsylvania, Penn, UPenn, Филадельфия, шт. Пенсильвания, США).
Большинство вакцин, предлагаемых для лечения других инфекционных заболеваний, пытаются запустить естественный иммунный ответ организма.
«В случае с ВИЧ естественный ответ не срабатывает. Если попытаться сымитировать такой ответ, ничего не получится. Одно из возможных решений состоит в настройке иммунной системы так, чтобы она реагировала на редкие участки в структуре вируса, которые менее склонны к мутациям. И такие „ахиллесовы пяты“ существуют».
Отто Янг (Otto Yang), заместитель директора Института изучения СПИДа при Калифорнийском университете в Лос-Анджелесе (UCLA, США).
Нынешние усилия ученых сравнимы со сверхсекретной работой криптоаналитиков времен Второй мировой войны в английском Блетчли-парке, которые трудились над взломом немецкой шифровальной машины «Энигма»: для разгадки неизвестного были собраны лучшие умы. Создание вакцины против ВИЧ вряд ли возможно без серьезного научного прорыва и привлечения целого множества методов.
«Даже если долгожданная вакцина появится, она вряд ли станет тем самым „волшебным средством“, которое вмиг решит проблему ВИЧ. Обязательно возникнут серьезные препятствия для ее повсеместного внедрения».
Моника Ганди (Monica Gandhi), директор Центра исследований СПИДа при Калифорнийском университете в Сан-Франциско (UCSF, США).
Пусть годами продолжающие поиски вакцины против ВИЧ пока безуспешны, зато ученые на этом пути многое узнали, что впоследствии пригодилось для стремительной разработки противоковидных вакцин. Исследования Каталин Карико (Katalin Karikó) и Дрю Вайсмана (Drew Weissman), удостоенные Нобелевской премии по физиологии и медицине в 2023 году и лежащие в основе мРНК-вакцин против коронавируса SARS-CoV-2, мгновенно изготовленных «Модерна» (Moderna) и «Пфайзер» (Pfizer) / «Байонтек» (BioNTech), начались два десятка лет назад, как раз преследуя цели победы над ВИЧ.
«Есть грустный афоризм, что до создания эффективной вакцины против ВИЧ остается 10 лет. Но наука не обязательно движется линейными темпами. За большим прорывом следуют итерационные изменения, а затем еще один прорыв».
Кэтрин Бар (Katharine Bar), врач-инфекционист и адъюнкт-профессор Пенсильванского университета (University of Pennsylvania, Penn, UPenn, Филадельфия, шт. Пенсильвания, США).
VIRTUS IN AEQUITATE. ДОБРОДЕТЕЛЬ В РАВЕНСТВЕ
Конференция AIDS 2024 не обошлась без участия активистов, которые собрались вокруг стенда «Гилеад», требуя от компании предоставить безоговорочный доступ к ленакапавиру всем страждущим. Плакаты и баннеры в их руках кричали: «Жадность „Гилеад“ убивает!», «Даешь дженерик ленакапавира!», «Долой патенты!», «Жизнь превыше прибыли!», «Ленакапавир — каждому!».

Отсутствие ясного понимания, какую бизнес-стратегию выберет «Гилеад» в ходе продвижения ленакапавира для доконтактной профилактики ВИЧ-инфекции, вылилось в массовое возмущение причастных к проблеме ВИЧ и СПИДа.
«Скорейшее внедрение ленакапавира во всех географических регионах и популяциях, нуждающихся в этом препарате, должно стать приоритетной задачей „Гилеад“ и всех заинтересованных сторон. Нуждающиеся люди, где бы они ни жили, должны как можно скорее получить доступ к этой многообещающей инновации для профилактики ВИЧ — заболевания, против которого не существует вакцин. На этот раз никто не может оставаться безучастным».
ЮНИТЭЙД (UNITAID), глобальная инициатива в области здравоохранения, которая содействует расширению доступа к лечению ВИЧ/СПИДа, малярии и туберкулеза и других смертоносных заболеваний в странах с низким и средним уровнем дохода.
«Мир с ужасом и стыдом вспоминает, что потребовалось десять лет и 12 миллионов загубленных жизней, прежде чем генерические версии АРТ-препаратов стали доступны во всём мире. Поделившись технологией ленакапавира, „Гилеад“ поможет спасти жизни людей, предотвратить ВИЧ-инфекции и прекратить самую смертоносную пандемию. „Гилеад“ может изменить историю».
Народный альянс по лекарственным средствам (People’s Medicines Alliance, PMA), глобальная коалиция организаций гражданского общества, экспертов и общественных деятелей, борющаяся за предоставление равного доступа к лекарствам и медицинским технологиям.
« „Гилеад“ должна уже сейчас лицензировать ленакапавир производителям дженериков. Но, похоже, она хочет затянуть этот процесс, чтобы сначала извлечь максимум прибыли на богатых рынках».
Винни Бьяньима (Winnie Byanyima), исполнительный директор Объединенной программы Организации Объединенных Наций по ВИЧ/СПИДу (ЮНЭЙДС) [Joint United Nations Programme on HIV and AIDS, UNAIDS, Женева, Швейцария].
«Ленакапавир изменит жизнь людей, подверженных риску заражения ВИЧ, и обратит эпидемию вспять, если станет доступным в странах с самым высоким уровнем новых инфекций. Нынешнее ценообразование на столь новаторские лекарства подрывает потенциал этого научного прорыва и замедляет глобальные усилия по преодолению проблемы ВИЧ и СПИДа. Гражданское общество должно продолжать оказывать давление на „Гилеад“, потому что без этого давления вряд ли компания поступит правильно».
Хелен Байгрейв (Helen Bygrave), советник по хроническим заболеваниям в международной некоммерческой медицинской гуманитарной организации «Врачи без границ» (Médecins sans frontières, MSF, Женева, Швейцария).
«Стопроцентная эффективность требует стопроцентного доступа. Ленакапавир для профилактики ВИЧ-инфекции — революционное средство, способное остановить пандемию. У „Гилеад“ имеется большой опыт противодействия глобальному доступу путем исключения стран со средним уровнем дохода из добровольных лицензионных сделок и искусственных ограничений лицензиатов. Четверть всех новых случаев заражения ВИЧ приходится на Россию, Бразилию, Филиппины, Украину и Таиланд — страны, которые „Гилеад“ всегда обходит стороной. Мы призываем правительства нарушить монополию „Гилеад“, выдавая принудительные лицензии везде, где ее патенты чинят препятствия».
Азия Рассел (Asia Russell), исполнительный директор Health GAP (Нью-Йорк, США), глобальной организации по защите прав ВИЧ-инфицированных.
«Биомедицинские достижения не покончат с ВИЧ, если каждый не получит к ним доступ. Фармкомпании монопольно контролируют поставки и ценообразование на новейшие препараты. Препятствуя доступу в странах со средним уровнем дохода, они не решают проблему, а перекладывают ее на других, в то время как правительства могли бы воспользоваться принудительными мерами, в том числе запрещая стратегии патентного обновления [evergreening] и выдавая принудительные лицензии».
Соланж Батист (Solange Baptiste), исполнительный директор Международной коалиции по готовности к лечению (International Treatment Preparedness Coalition, ITPC, Йоханнесбург, ЮАР).
«Миллионы наших братьев и сестер, друзей и соседей сталкиваются с проблемами стигмы, бремени таблеток и приверженности, в результате чего они остаются незащищенными от заражения ВИЧ. Настало время, чтобы фармацевтические компании, правительства и доноры сыграли свою роль в обеспечении доступа к недорогим непатентованным версиям ленакапавира для африканских сообществ, которые всецело поддержали его разработку. Мы призываем „Гилеад“, правительства, ВОЗ и доноров в лице Фонда Билла и Мелинды Гейтс, ЮНИТЭЙД, Детского инвестиционного фонда (CIFF), Глобального фонда, Чрезвычайного плана президента США по борьбе со СПИДом (PEPFAR), Агентства США по международному развитию (USAID) без каких-либо промедлений и задержек приступить к широкомасштабному внедрению ленакапавира, чтобы навсегда покончить с эпидемией».
Африканское Партнерство по доступу к лечению (AfroCAB, Лусака, Замбия).
«Стало ясно, что неравенство, а не наука, является самым большим препятствием в борьбе со СПИДом. От имени тех из нас, кто посвятил свою жизнь этой работе, чьи исследования стали основой для разработки этого лекарства, я настоятельно призываю „Гилеад“ устранить неравенство и сделать монументальный шаг к прекращению пандемии СПИДа».
Франсуаза Барре-Синусси (Françoise Barré-Sinoussi), лауреат Нобелевской премии 2008 года в области физиологии и медицины за открытие вируса иммунодефицита человека (ВИЧ).
«Такие препараты, как ленакапавир, должны рассматриваться как общие мировые блага, и необходимо найти способы сделать их доступными для всех. Представление о том, что фармацевтические компании, являющиеся бенефициарами значительных государственных инвестиций в научные исследования, могут получать огромные прибыли и не делиться созданной интеллектуальной собственностью, ошибочно».
Хелен Кларк (Helen Clark), председатель Глобальной комиссии по вопросам наркополитики (Global Commission on Drug Policy, GCDP, Женева, Швейцария) и бывший премьер-министр Новой Зеландии.
«Ленакапавир способен провернуть революцию, но этому мешает жадность. Почему коммерческая организация вправе распоряжаться здоровьем людей? Цена на такие важные лекарства должна основываться на стоимости производства, а не подпитываться алчностью большой фармацевтической компании».
Отоман Меллук (Othoman Mellouk), руководитель программы по интеллектуальной собственности и доступу к лекарствам Международной коалиции по готовности к лечению (International Treatment Preparedness Coalition, ITPC, Йоханнесбург, ЮАР).
«Теперь, когда цель покончить с СПИДом стала реальной, от руководства „Гилеад“ требуется смелое решение. У компании есть все шансы перевернуть страницу смертоносного пренебрежения фармацевтической промышленности к африканцам, живущим с ВИЧ. В этот исторический момент я призываю „Гилеад“ действовать в духе солидарности и гуманитарного сотрудничества, сделав всё необходимое, чтобы положить конец этой ужасной пандемии».
Фестус Могае (Festus Mogae), бывший президент Ботсваны.
«Миллионы жизней были потеряны в Африке, пока фармацевтические компании продавали лекарства от ВИЧ только богатым. Посыл был ясен: для „Большой Фармы“ наши жизни не имеют значения. „Гилеад“ должна решить, изменилась ли ситуация. Ценит ли компания жизни людей на Глобальном Юге так же, как и в обеспеченных странах? Или мы по-прежнему будем лишены возможности пользоваться огромными научными достижениями в борьбе со СПИДом?»
Анеле Ява (Anele Yawa), генеральный секретарь Группы «Действенное лечение» (Treatment Action Campaign, TAC, Йоханнесбург, ЮАР), южноафриканской организации активистов по борьбе с ВИЧ/СПИДом.
«Компании должны делиться своими лекарствами. Недопустим апартеид в доступе к медицине, когда жизнь людей, живущих на Глобальном Юге, не рассматривается как имеющая ту же ценность, что и жизнь людей на Севере».
Табо Макгоба (Thabo Makgoba), архиепископ Англиканской церкви Кейптауна (ЮАР).
«В Индии мы будем бороться с патентами „Гилеад“ на ленакапавир, чтобы обеспечить поставки дженериков во все страны с низким и средним уровнем дохода»
Лун Гангте (Loon Gangte), основатель Делийской сети людей, живущих с ВИЧ (Delhi Network of Positive People, DNP+, Нью-Дели, Индия).
«Бразилия — страна с высоким уровнем заболеваемости ВИЧ. Мы не должны быть лишены доступа к таким превосходным технологиям профилактики, как ленакапавир. Наша система здравоохранения не должна платить „Гилеад“ непомерно высокую цену. Мы должны использовать правовые механизмы для предотвращения злоупотреблений патентной системой и защиты жизни людей».
Сузана ван дер Плуг (Susana van der Ploeg), юрист рабочей группы по интеллектуальной собственности Бразильской междисциплинарной ассоциации по СПИДу (Associação Brasileira Interdisciplinar de AIDS, ABIA, Рио-де-Жанейро, Бразилия).
«Из добровольной лицензии „Гилеад“ должны быть исключены все условия, блокирующие и сдерживающие НИОКР, регистрацию ленакапавира и поставки его дженериков, включая контроль над поставками API и высокое роялти. Не должно быть никаких ограничений, препятствующих генерическим производителям поставлять ленакапавир в страны, исключенные из добровольной лицензии, а правительства должны выдавать принудительные лицензии или использовать другие гибкие возможности ТРИПС».
Чалермсак Киттитракул (Chalermsak Kittitrakul), руководитель проекта по доступу к лекарствам из Тайской сети людей, живущих с ВИЧ (Thai Network of People Living with HIV/AIDS, TNP+, Бангкок, Таиланд).
«Пандемия СПИДа всегда была кризисом в области прав человека, и когда людям, которым это нужно, отказывают в доступе к спасительному лекарству, это попросту отказ в праве на здоровье. В «эпоху медицинской дезинформации», когда в ход идут теории заговора, у „Гилеад“ есть шанс изменить репутацию «Большой Фармы», которая ставит прибыль выше человеческих жизней, соблюсти обязательства в области прав человека и обеспечить полную реализацию потенциала ленакапавира как высокоэффективного лекарства от ВИЧ».
Керри Кеннеди (Kerry Kennedy), президент Центра по правам человека имени Роберта Ф. Кеннеди (Robert F. Kennedy Human Rights, Вашингтон, США).
«Ленакапавир — источник надежды. Но нет смысла разрабатывать новые лекарства, если они не достигают людей, чьи жизни могут спасти. Ленакапавир — ответ для тысяч африканских женщин, мужчин, девочек и мальчиков, живущих с ВИЧ, и всех тех, кто не получает безопасный доступ к обычному лечению, не опасаясь насилия или дискриминации. Руководители „Гилеад“, рассматривающие нашу просьбу, должны знать, что жизни многих из этих людей висят на волоске».
Моника Чаквера (Monica Chakwera), первая леди Малави.
«Достижение цели 2030 года по искоренению СПИДа как угрозы здоровью человечества зависит от решения „Гилеад“: если она быстро и справедливо поделится ленакапавиром со всеми странами с низким и средним уровнем дохода».
Джойс Оума (Joyce Ouma), специалист из Y+ Global (Амстердам / Нидерланды, Кейптаун / ЮАР), глобальной сети молодежи с ВИЧ.
VOX POPULI, VOX DEI. ГЛАС НАРОДА — ГЛАС БОЖИЙ
Интернет, объединивший всех во всём мире, предоставил возможность транслировать каждому свою точку зрения на происходящее. Давайте посмотрим, как отреагировали люди на известия о невероятных профилактических успехах ленакапавира и как высказывались на онлайновых площадках ведущих американских изданий, таких как «Нью-Йорк таймс» (New York Times), «Уолл-стрит джорнэл» (Wall Street Journal), «Вашингтон пост» (Washington Post).
«Меня озадачивают постоянные утверждения о том, что ВИЧ-инфицированные не могут как-то справиться с приемом всего лишь одной таблетки раз в день и что просить их об этом — сродни запретительному требованию. Я сам уже многие годы пью лекарства от повышенного давления, и делаю это каждый день.
Мне кажется, что те, кто пытается избежать PrEP, пытаются, скорее всего, избежать ответственности за свое здоровье или влияние на других. Предоставляя такой категории людей различные препараты, чтобы они могли продолжать вести неупорядоченную и безответственную жизнь, вы только усугубляете саму проблему. Правильнее направлять их к пересмотру своего безнадежного и опасного поведения, напоминающего диких животных.
Всё это сродни тому, как давать профилактические препараты тем, кто просто хочет заниматься беспорядочным сексом безо всяких последствий. Подобное потворствование подвергает риску всё общество, позволяя болезням адаптироваться к нашим редким полезным лекарствам, таким как антибиотики, — всего лишь для того, чтобы небольшая антисоциальная группа могла заниматься случайным сексом по своему усмотрению».
«Нельзя таким безапелляционным и вопиющим образом стыдить жертв инфекции, в том числе потенциальных. У многих людей в мире трудности с постоянным жильем, а ввиду низкого социально-экономического статуса они подвержены влиянию алкоголя и запрещенных веществ, зачастую страдают психическими расстройствами. Это означает, что для них соблюдение режима приема лекарства — большое препятствие. У других людей, в целом из благополучного окружения, прогрессирующие заболевания печени, почек и множество иных недугов, и ежедневные таблетки только усугубят проблему со здоровьем. Так что ленакапавир длительного действия — реальный выход из положения».
«Методы, которые работают лучше всего, — те, о которых можно не помнить: например, внутриматочные спирали или имплантаты. Напротив, методы, требующие от человека каких-то регулярных действий, например, ежедневные, еженедельные или ежемесячные таблетки, кольца или пластыри, пусть даже весьма эффективные при должном использовании, на практике оказываются малополезными, потому что редко кто следует инструкции по их применению».
«Почему вы не ставите под сомнение все те данные, которыми вас кормят с ложечки? К примеру, 39 миллионов человек, живущих с ВИЧ, — неужели кто-то колесит по всей Африке, чтобы собрать эту информацию? Если говорить о профилактике, задумайтесь, стали бы вы принимать лекарства для предупреждения заражения тем же герпесом? Очевидно, что нет, потому что это никого не заботит: есть более-менее работающие лекарства. Так и здесь, мало кто будет покупать дорогостоящие таблетки или уколы, чтобы обезопасить себя от ВИЧ, который вполне поддается терапии».
«Я думаю обо всех друзьях, которых потерял в середине–конце 1980-х гг. и начале 90-х, когда AZT был тем препаратом, за которым приходилось летать в Мексику. Это лекарство с ужасными побочками, которое в лучшем случае лишь ненадолго продлевало жизнь. Как бы они удивились, узнав, насколько далеко продвинулась наука и лечение ВИЧ-инфекции, позволяющее фактически „обнулить“ вирус, снизив его уровень до необнаружимого. Подозреваю, что исследования ВИЧ помогают понять и разработать лечение других инфекционных заболеваний».
«Проблема в способе введения таких лекарств, как ленакапавир. Болюсная инъекция микрокристаллического препарата, рассчитанная на 6 месяцев, является очень большой инъекцией веществ, которые организм не может легко метаболизировать. Cо временем могут развиться серьезные и необратимые повреждения тканей, в которые они вводятся: например, фиброзные участки, кисты, язвы, некроз. Так что хронические инъекции ленакапавира разумно осуществлять всегда в разные места».
«Всё это хорошо и здорово, но как насчет личной ответственности? Случайный незащищенный секс является причиной распространения этой болезни. Чья-то распущенность и безответственность — это наши финансовые и социальные потери».
«Предлагаю решения, чтобы уменьшить количество случайных незащищенных половых связей: всестороннее сексуальное воспитание, начиная с младших классов средней школы; прекращение криминализации услуг по охране репродуктивного здоровья; просвещение об опасности наркотиков, которые увеличивает риск незащищенного секса, особенно алкоголя. Образование — лучшее оружие, которое у нас есть».
«Я уверен, что почти каждый человек на Земле будет счастлив выложить 42 тысячи долларов в год за два укола. Жаль, что ленакапавир изобрел не Джонас Солк. Он совершенно бесплатно отдал свою вакцину от полиомиелита, которая, судя по расчетам, стоила 7 миллиардов долларов, если бы была запатентована».
«Доступ к лекарствам всегда был проблемой: будь то поиск того, кто выпишет рецепт, или оплата за него. Кроме того, каждое лекарство или лечение имеет свой процент неудач, ничто не может быть 100-процентно эффективным. Однако даже 50% лучше, чем 0%. Лечение ВИЧ на протяжении всей жизни обходится гораздо дороже, чем его профилактика».
«Соблюдение режима приема лекарств может быть сложной задачей, но просить кого-то принимать один раз в день таблетки для профилактики и/или лечения смертельного заболевания — не так уж и сложно. Одно но: вас могут не услышать».
«Замечательные новости! Ленакапавир — своего рода вакцина от ВИЧ. Безумные антипрививочники будут разглагольствовать и бесноваться».
«У меня есть знакомый с ВИЧ, который принимает препарат „Биктарви“, выпускаемый „Гилеад“. И это худшая из фармкомпаний, когда дело доходит до обдираловки потребителей. Лекарство, поддерживающее его нормальную жизнь, стоит более 40 тысяч долларов в год, и продолжает дорожать. Несмотря на то что „Гилеад“ является лидером в производстве препаратов против ВИЧ, цены на них преступны и выходят далеко за рамки необходимого для получения огромных прибылей. Чтобы удержать клиента, „Гилеад“ зачастую предлагает „подарки“, то есть купоны, чтобы хоть как-то возместить реально неподъемные пациентские расходы на доплату к страховке. Самое печальное, что этот препарат, возможно, лучший на рынке, и компания этим безжалостно пользуется. Вот и вся филантропия. На запатентованных страданиях других».
«Лучшие новости в области здравоохранения с тех пор, как было объявлено о доступности прививок от ковида».
«Даже одна таблетка в день для PrEP — фантастическое улучшение в сравнении с временами, когда для лечения ВИЧ-инфекции их приходилось пить буквально горстями. Однако всё та же одна таблетка — это каждодневное напоминание самому себе, что ты в группе риска. Подобный бесконечный психологический удар рано или поздно вылезет боком. Жизнь без таблеток на протяжении долгих шести месяцев — надо плясать и петь, что ленакапавир подарил столь захватывающий праздник, избавил от ужасного бремени, максимально приблизил к „нормальному“ или „анонимному“ состоянию всех, кто принимает PrEP-препараты».
«Людям нужна свобода выбора: кому-то подходят ежедневные таблетки, тогда как другим такой прием действительно опасен, потому что раскрывает их статус для нетерпимых окружающих. Ленакапавир, мы тебя ждем!»
«Почему больные сердечно-сосудистыми заболеваниями, диабетом или чем-то еще не получают такого повышенного и концентрированного внимания, как ВИЧ-инфицированные или находящиеся в группе риска? ВИЧ-инфекция — болезнь, которую можно полностью предотвратить, если, конечно, вы не родились с ней, не живете в гетто или Африке. Так что если вы не можете принимать ежедневные PrEP-таблетки — значит, вам нужна помощь иного типа, а не сами эти лекарства. Хватит врать самим себе!»
«Распространение пугающей информации о ВИЧ/СПИДе заставило всё мое поколение использовать презервативы для безопасного секса. Я до сих пор этого боюсь, причем даже с партнерами, которым в остальном доверяю. Сейчас страх незащищенного секса сошел на нет: к чему беспокоиться, если есть лекарства, и ВИЧ уже не приговор. Отсюда и стремительный рост случаев венерических заболеваний. Когда препараты могут устранить негативные последствия приятного занятия, его становится больше, независимо от того, есть ли другие менее известные исходы. Поэтому создание женских контрацептивов привело к „сексуальной революции“, поскольку устранило последствия нежелательной беременности. Неужели ленакапавир изменит ситуацию? Как вы думаете, что произойдет, если бы мы устранили последствия любого приятного или приносящего удовлетворения действия?»
«Как хорошо, что „Гилеад“ хочет немного снизить количество смертей, но при этом сохранить их на уровне, достаточном для извлечения максимальной прибыли. Как говорится, «всё, что вынесет рынок». В фарминдустрии есть следствие из пословицы „Научи человека рыбачить…“: убив одного человека, ты прокормишь себя на день, но убивая тысячи и продолжая это делать, можно стать неприлично богатым. То, сколько фармгиганты берут за жизненно важные препараты, уносит жизни тысяч людей по всему миру каждый день. Они продолжают богатеть на нашей крови, пока мы позволяем».
«К сожалению, у тех, кто принимает PrEP-препараты, возникает ощущение неуязвимости. Это уже привело к резкому росту случаев сифилиса и других ИППП, причем некоторые заболевания становятся устойчивыми к лекарствам. Люди не хотят быть благоразумными в своих действиях. Ощущение неуязвимости, возникшее и подпитываемое благодаря более совершенным способам лечения и профилактики ВИЧ, повлечет за собой разрушительные последствия — худшие, чем затянувшаяся стигма, оставшаяся со старых добрых времен, когда страх сдерживал поведение».
«И если людям на Западе действительно нужно учиться обуздывать свои сексуальные желания, практиковать близость с малым числом партнеров и регулярно проходить проверку на ВИЧ, то живущим в Африке всё это не подходит. Там запросто могут изнасиловать женщину или выдать ее замуж, где с ней будут делать всё, что заблагорассудится. Ленакапавир должен стать бесплатным в тех местах, где у людей нет фундаментального права на собственное тело».
«Никто в США не будет платить полную цену за дорогущий ленакапавир, даже если бы он был в сто тысяч раз эффективнее. Разве что очень богатые люди, которые не любят презервативы. Страховые компании вряд ли согласятся покрывать расходы на препарат — они попросту обанкротятся ввиду массы желающих получить это PrEP-средство».
«Как же прекрасно для мира, что жадность снова побеждает в вопросе спасения жизней. Эй, фармацевты, не могли бы вы показать еще более ужасное лицо?»
«Если потрясающие результаты ленакапавира подтвердятся в более масштабных испытаниях или в ходе постмаркетинговых исследований, это станет, наряду с вакциной от COVID-19, самой, вероятно, важной разработкой с момента появления противотуберкулезных лекарств и антималярийных средств».
«Вправе ли производитель устанавливать цены на лекарства так, чтобы максимизировать прибыль, исключая при этом большинство тех, кто мог бы получить от них пользу? Безусловно, ленакапавир — дорогостоящее научное достижение, и производитель заслуживает достойного вознаграждения. Но только не за счет человеческих жизней. Бремя ВИЧ для общества колоссально. Государствам и ВОЗ следует найти приемлемое соглашение с „Гилеад“, учитывая ту экономию средств, которая ожидается ввиду снижения затрат на лечение ВИЧ и СПИДа».
«„Гилеад“ всего лишь монетизирует ВИЧ. Стоящие за ней акционеры совсем не заинтересованы в уничтожении вируса, ведь на нем можно заработать столько денег. Если бы они действительно хотели спасти человечество, то незамедлительно отказались бы от патента».
«Нам могут рассказывать любые маркетинговые и деловые сказки о всех тех сложностях и огромных затратах, которые сопутствовали разработке того или иного лекарства. В реальности же исследования зачастую финансируются государством, а затем их результаты присваиваются фармацевтическими компаниями. Сама идея о том, что фармбизнес нуждается в государственных дотациях для лечения стран третьего мира (жителей которых используют в качестве подопытных кроликов для клинических испытаний экспериментальных препаратов), представляет собой не капитализм, а корпоративную коррупцию с необоснованным двойным субсидированием. Настоящая кормушка для лоббистов».
«Вместо того чтобы бороться с отвратительными культурными традициями Африки, где еженедельно тысячи молодых женщин и девочек-подростков заражаются ВИЧ, Запад собирается субсидировать высокоэффективное PrEP-лекарство, чтобы патриархат и дальше сексуально эксплуатировал по сути детей. Это отличный пример того, почему все усилия общественных организация в этом регионе попросту проваливаются. Неправильные проблемы, неправильная диагностика, неправильное лечение, неправильная реализация — и даже после 80 лет паразитического существования на страданиях Африки результаты всех начинаний и проектов без малого ужасы».