ЧТО ПРОИЗОШЛО
«Рош» (Roche) всеми силами старается запрыгнуть в стремительно мчащийся экспресс лекарственных препаратов для похудения.
ОСНОВНЫЕ ФАКТЫ
«Рош» поставила перед собой задачу прямой конкуренции с «Ново Нордиск» (Novo Nordisk) и «Илай Лилли» (Eli Lilly), ведущими игроками на рынке современных лекарственных средств, предназначенных для долгосрочного снижения веса.
Первые препараты против ожирения выйдут из стен швейцарского фармацевтического гиганта ориентировочно в 2027–2028 гг.
Их разработка осуществляется благодаря приобретенной в конце января 2024 года «Кармот терапьютикс» (Carmot Therapeutics), за которую было выложено авансовых $2,7 млрд наличными с последующими потенциальными выплатами до $400 млн по мере развития лекарственных программ [1] [2].
Согласно промежуточным данным, лекарственные проекты «Кармот» характеризуются эффективностью и безопасностью, которые превосходят большинство нынешних препаратов, одобренных и экспериментальных.
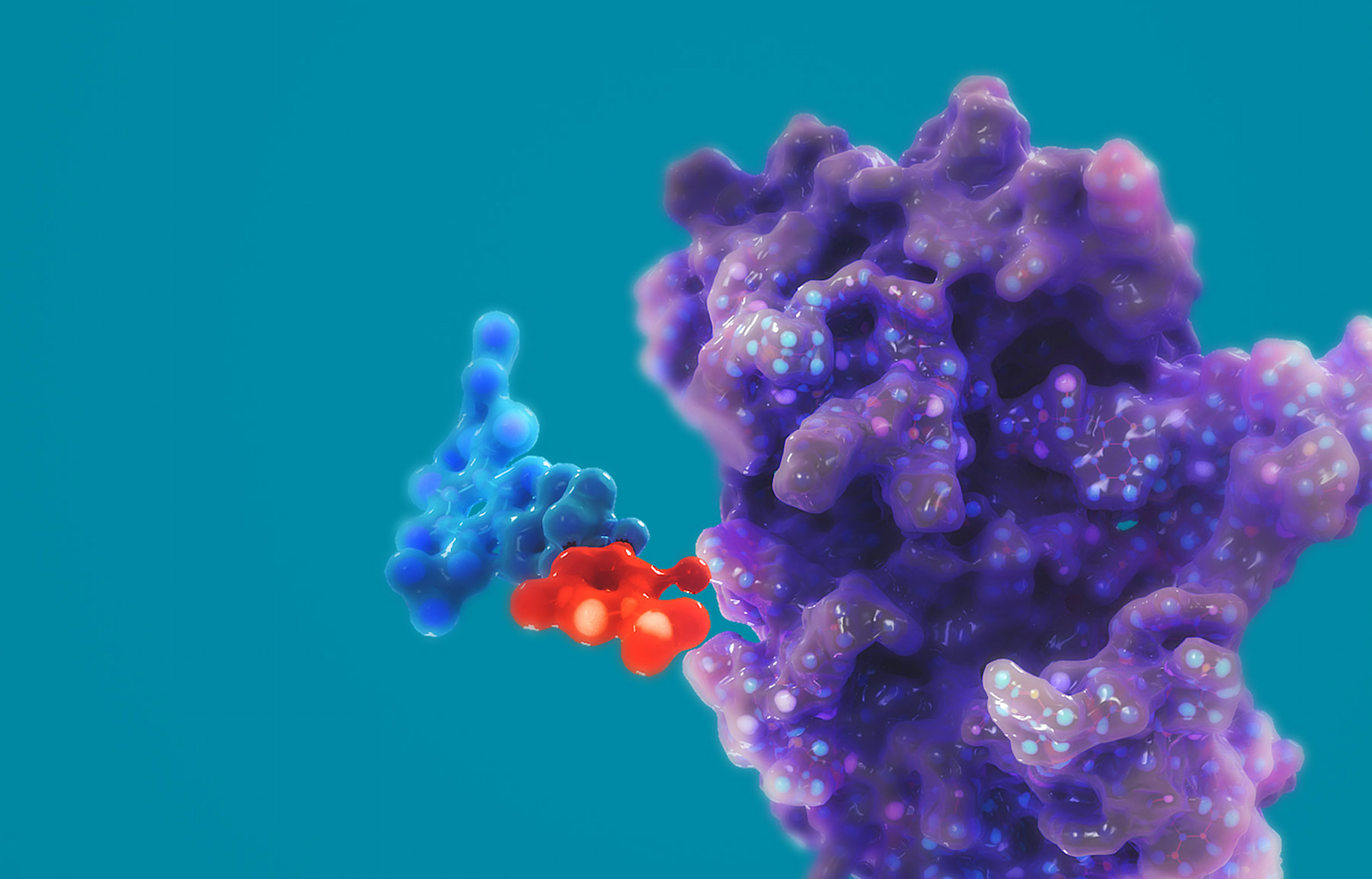
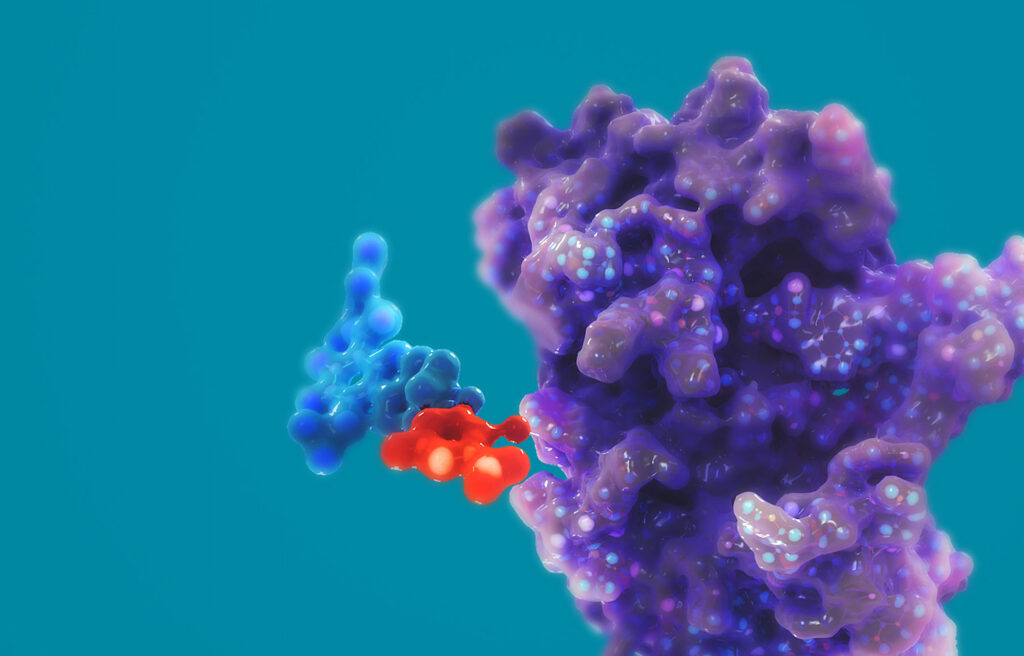
Изучаемые молекулы относятся к классу агонистов рецептора глюкагоноподобного пептида-1 (GLP1RA) и агонистов рецептора глюкозозависимого инсулинотропного полипептида (GIPRA), вокруг которых построены почти все нынешние усилия фармацевтической отрасли, занимающейся вопросами ожирения.
Благодаря тому, что GLP1RA/GIPRA-препараты «Кармот» являются либо гибридными, сочетающими пептидные и низкомолекулярные фрагменты, либо чисто низкомолекулярными, они проще в исследовании и производстве, нежели полностью пептидные лекарства конкурентов. Однако они также менее предсказуемы, чем только пептидные, в том, что касается неожиданных побочных эффектов.
Между тем поздний вход «Рош» в бизнес лечения ожирения приведет к тому, что, согласно отраслевым прогнозам, она сможет заработать на этом лишь $4 млрд к 2032 году. И это крохи с учетом предполагаемого размера этого рынка в $150 млрд к 2033 году — против жалких $0,5 млрд в 2020-м.
Успехи современных препаратов против ожирения, способствующих снижению веса на 15–25% за год-полтора, отражаются безумным спросом на них. Нет никаких сомнений, что «Оземпик» (Ozempic, семаглутид) и «Вегови» (Wegovy, семаглутид), GLP1RA-препараты «Ново Нордиск», и «Мунджаро» (Mounjaro, тирзепатид) и «Зепбаунд» (Zepbound, тирзепатид), GLP1RA/GIPRA-препараты «Илай Лилли», еще долгое время будут лидировать, зарабатывая десятки миллиардов долларов.

Тирзепатид: мощный прорыв в профилактике диабета
Трехлетний курс лечения тирзепатидом против лишнего веса на 94% снизил риск развития сахарного диабета 2-го типа.
ПРЯМАЯ РЕЧЬ
«Ожирение — это не просто косметическая проблема, а серьезное недомогание, ассоциированное с диабетом, болезнями сердца и почек, раком».
Ману Чакраварти (Manu Chakravarthy), старший вице-президент и руководитель глобального подразделения разработки продуктов в области сердечно-сосудистых заболеваний, болезней почек и метаболических расстройств «Рош» (Roche), а до этого — глава исследований и разработок и медицинский директор «Кармот терапьютикс» (Carmot Therapeutics).
«Мы гордимся своей лекарственной программой по борьбе с ожирением и диабетом и уверены, что она, благодаря различным способам применения и комбинирования, удовлетворит потребности и изменит жизнь пациентов к лучшему».
Хезер Тернер (Heather Turner), исполнительный директор «Кармот терапьютикс» (Carmot Therapeutics).
«Эпидемия ожирения — мировой кризис, который продолжает усугубляться, обещая к 2035 году охватить почти половину населения планеты — более 4 миллионов человек. Это создает невероятную нагрузку на общество и системы здравоохранения по всей Земле».
Тим Куцки (Tim Kutzkey), председатель совета директоров «Кармот терапьютикс» (Carmot Therapeutics).
«Собранные клинические данные вселяют оптимизм и дают надежду вывести на рынок лучшую в своем классе терапию, предоставляющую стойкое снижение веса и надежный контроль над уровнем глюкозы».
Леви Гаррауэй (Levi Garraway), исполнительный вице-президент, медицинский директор и руководитель глобального развития продукции «Рош» (Roche).
«Ожирение — гетерогенное заболевание, которое способствует развитию многих других болезней, и всё это налагает значительное бремя на весь мир».
Томас Шинекер (Thomas Schinecker), исполнительный директор «Рош» (Roche).
СУТЬ ВОПРОСА
Современные пептидные GLP1RA-препараты разработаны с прицелом на пролонгированную фармакокинетику так, чтобы их терапевтическое назначение осуществлялось редко — один раз в неделю. Для реализации этого пришлось прибегнуть к модификации аминокислотной последовательности для устойчивости к протеолитическим ферментам, конъюгации с жирными кислотами для обратимого связывания с альбумином и предотвращения клубочковой фильтрации, ковалентному связыванию с фрагментами антител [1].
Пептидные компоненты всех одобренных GLP1RA-препаратов берут начало либо от самого глюкагоноподобного пептида-1 (GLP1), либо от его паралога эксендина-4 (exendin-4). Оба родоначальника являются агонистами GLP1 (GLP1A) с низкой наномолярной аффинностью и высокой потентностью к выработке циклического аденозинмонофосфата (цАМФ) [2].
Сохранение всех этих фармакологических свойств в контексте структурных модификаций, необходимых для улучшения фармакокинетики, было основным принципом изучения взаимосвязи структуры и активности для лираглутида (liraglutide) и семаглутида (semaglutide) [3].
Однако более широкое признание сложности сигнализации рецепторов, сопряженных с G-белком (GPCR), заставило пересмотреть этот подход. Растет интерес к идее создания более эффективных и более переносимых GLP1A за счет тонкой настройки взаимодействия с нижележащими сигнальными путями, что обычно называют смещенным агонизмом [4].

Стартапы против гигантов: битва за будущее лекарств
Сейчас большего всего новых лекарств придумывают биотехнологические стартапы, но почти все деньги уходят в карман «Большой фармы».
КАК ЭТО РАБОТАЕТ
«Кармот», воспользовавшаяся фирменной платформой поиска лекарственных соединений «Эволюция хемотипов» (Chemotype Evolution), провела последовательные итерационные этапы синтеза и скрининга библиотек в целях эффективной оптимизации молекул-кандидатов с должным набором свойств и характеристик, включая сигнализацию, биодоступность, долю активного вещества препарата, период полувыведения. И вот что у нее получилось.
Когда инкретиновый гормон в лице GLP1 или глюкозозависимого инсулинотропного полипептида (GIP) связывается со своим рецептором, относящимся к GPCR, этот рецептор меняет форму, что приводит к активации комплекса G-белка и нижележащего сигнального пути цАМФ. Попутно происходит рекрутинг бета-аррестина к рецептору, что отражается снижением сигнализации G-белка (частично за счет транспортировки рецептора). Если ослабить или устранить процесс рекрутинга бета-аррестина, можно добиться более мощного терапевтического эффекта в виде более сильного и продолжительного снижения уровня глюкозы и потери веса [1].

Для этого «Кармот» обратилась к смещенному агонизму рецепторов GLP1 и GIP, спроектировав свои молекулы так, чтобы они активировали цАМФ при минимальном или нулевом рекрутинге бета-аррестина. Избавление от рекрутинга и интернализации (эндоцитоза) бета-аррестина, которые ведут к десенсибилизации (деградации) рецепторов, результировало расширившимся терапевтическим окном с продолжительной фармакологической активностью и улучшенной переносимостью.

Тирзепатид (tirzepatide), предложенный «Илай Лилли» как «Мунджаро» и «Зепбаунд», — на сегодня единственный одобренный двойной агонист рецепторов GLP1 или GIP. Он обладает смещенным агонизмом только в отношении GLP1 с очень низким рекрутингом бета-аррестина, но не делает этого в отношении GIP.
Как полагает «Кармот», ее экспериментальные препараты способны оказать больший терапевтический эффект, чем тирзепатид, если говорить о степени контроля над гликемией и снижении массы тела, и характеризуются менее выраженными нежелательными явлениями.

«Зепбаунд»: сильнейшее лекарство для похудения
Еженедельные инъекции тирзепатида — минус 24 килограмма за полтора года.
ПОЧЕМУ ЭТО ВАЖНО
Современные GLP1RA-препараты совершили революцию в лечении ожирения: прежде небывалая эффективность снижения веса, по сути не требующая каких-либо решительных мер по изменению образа жизни, заставила миллионы людей вновь поверить в себя.
Однако применение этих лекарственных средств столкнулось с серьезным дозозависимым ограничением: при увеличении назначаемой дозы растет частота нежелательных явлений (НЯ) со стороны желудочно-кишечного тракта (ЖКТ). Вот почему многие не могут воспользоваться всей мощью GLP1RA-препаратов ввиду невозможности выйти к высокой дозе из-за непереносимости таких НЯ, как тошнота, рвота, диарея, запор. Более того, в целях снижения частоты НЯ приходится следовать продолжительному (вплоть до 20 недель) курсу постепенного повышения дозы, чтобы организм адаптировался к GLP1RA-препаратам. Наконец, инъекционные лекарства требуют особых условий хранения при пониженной температуре.
«Ребелсас» (Rybelsus, семаглутид) производства «Ново Нордиск», единственный на рынке пероральный GLP1RA-препарат, обязывает принимать себя хотя бы за 30 минут до еды: ввиду низкой биодоступности лекарства существует риск снижения терапевтического эффекта.

«Ребелсас»: фармакологический прорыв в лечении сахарного диабета
Novo Nordisk выпустила семаглутид в виде таблеток.
ПАЙПЛАЙН
CT-388 (RG6640) — пептидно-низкомолекулярный GLP1RA/GIPRA, назначаемый подкожными инъекциями один раз в неделю для терапии ожирения и сахарного диабета 2-го типа (СД2).
CT-868 (RG6641) — пептидно-низкомолекулярный GLP1RA/GIPRA, применяемый подкожными инъекциями один раз в день в качестве дополнения к инсулинотерапии сахарного диабета 1-го типа при сопутствующем лишнем весе или ожирении.
CT-996 (RG6652) — пероральный низкомолекулярный GLP1RA, используемый один раз в день для терапии ожирения и СД2. Не исключено, препарат найдет применение для поддерживающего режима после прохождения курса по снижению веса, инициированного инъекционными лекарствами.
КЛИНИЧЕСКИЕ ПОДРОБНОСТИ
CT-388
Клиническое исследование NCT04838405 фазы I изучило еженедельные подкожные инъекции CT-388 (8 или 22 мг) среди взрослых пациентов (n=46), страдающих либо ожирением или избыточной массой тела, либо ожирением и сахарным диабетом 2-го типа (СД2).
По прошествии 24 недель назначение CT-388 в дозе 22 мг привело к снижению веса на усредненных 18,8% (95% ДИ [здесь и далее]: −23,6, −14,0) среди лиц с ожирением (индекс массы тела [ИМТ] ≥ 30,0 кг/м2) и без СД2 относительно плацебо (p<0,001): −18,9±1,1% против −0,1±2,1% [1] [2].
Был отмечен дозозависимый эффект: по истечении 12 недель получавшие 8- или 22-мг дозу препарата потеряли абсолютных 10,2±1,3% и 12,4±0,9% веса, или 9,3% (−13,4, −5,2) и 11,5% (−15,1, −7,9) относительно плацебо.
Похудение минимум на 5%, 10%, 15% и 20% было зарегистрировано для соответственно 100%, 85%, 70% и 45% участников, получавших 22-мг дозу CT-388.
Зафиксировано снижение уровня (p<0,001) гликированного гемоглобина (HbA1c) и глюкозы натощак: на 0,4% и 10,2 мг/дл относительно плацебо. Все испытуемые, у которых был преддиабет до начала исследования, вышли к нормогликемии.
Профиль безопасности CT-388 беспокойств не вызвал: спектр и частота нежелательных явлений, носивших в основном легко-умеренную степень выраженности, укладывались в привычные для препаратов инкретинового класса рамки.
CT-868
Клиническое исследование NCT05110846 фазы II проверило ежедневные подкожные инъекции CT-868 (1,75; 3,25 или 4 мг) среди взрослых пациентов (n=103) с СД2 (HbA1c 7–10%) и сопутствующим ожирением или лишним весом.
По прошествии 26 недель назначения CT-868 уровень HbA1c снизился на 1,16%, 1,63% и 2,03% — против его роста на 0,30% в группе плацебо. Уровень глюкозы в крови удалось довести до целевого при СД2 (HbA1c ≤ 6,5%) среди 52%, 72% и 69% участников — против 18%. К нормогликемии (HbA1c < 5,7%) вышли 13%, 28% и 24% испытуемых — против 5%. Уровень глюкозы натощак по отношению к плацебо снизился на 53–60 мг/дл [1].
Улучшился липидный профиль: за счет падения уровней общего холестерина, холестерина липопротеинов низкой плотности (ЛПНП), холестерина липопротеинов очень низкой плотности (ЛПОНП), триглицеридов, аполипопротеина B.
Улучшились печеночные пробы: благодаря снижению уровней аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глутамилтрансферазы (ГГТ).
Применение CT-868 обеспечило уменьшение массы тела на 2,3%, 3,0% и 5,7% — против ее снижения на 2,3% в группе плацебо.
CT-996
Продолжается клиническое испытание NCT05814107 фазы I, тестирующее ежедневное пероральное назначение CT-996 (в разных дозах) среди взрослых пациентов (n=95) с ожирением или лишним весом, наличием СД2 или без него.
В части 2 исследования участники (n=25) с ожирением и без СД2 были разнесены на три когорты, следовавших следующим схемам приема CT-996 или плацебо:
- когорта 1: 10 мг ➞ 30 мг ➞ 60 мг ➞ 90 мг;
- когорта 2: 10 мг ➞ 30 мг ➞ 60 мг ➞ 90 мг ➞ 120 мг;
- когорта 3: 10 мг ➞ 30 мг ➞ 50 мг ➞ 80 мг ➞ 120 мг.
Ступенчатое повышение дозы препарата осуществлялось быстро (на 4-й, 8-й, 15-й и 22-й день), чтобы без промедлений зарегистрировать какие-либо ранее упущенные или неожиданные сигналы, касающиеся безопасности.
После 4 недель лечения вес уменьшился на 2,3%, 5,8% и 7,3% в когортах CT-996 — против его снижения на 1,2% в группе плацебо (н/з, p<0,01, p<0,001). В когорте 3 разница с плацебо составила 6,1% [1].
Установлено, что уровень CT-996 в крови почти не зависел от его приема натощак или вместе с пищей с высоким содержанием жира.
Каких-либо серьезных проблем с безопасностью не выявлено. Ввиду стремительного повышения дозы CT-996 нежелательные явления со стороны желудочно-кишечного тракта носили частый характер: в дальнейшем, когда прибавка дозы будет проводиться более плавно, их частота снизится. Однако частота пульса выросла на 15 уд./мин (это много, если сравнивать с другими препаратами), а один человек столкнулся с повышением уровня липазы (свидетельствует о проблемах с поджелудочной железой).









Орфорглипрон: таблетка для неспешного похудения
Девять месяцев каждодневного лечения — и минус 15 килограмм лишнего веса.
ЧТО ДАЛЬШЕ
Продолжается 48-недельное клиническое исследование NCT06525935 фазы II (n=450), тестирующее CT-868 при либо ожирении, либо лишнем весе с сопутствующим ему заболеванием (преддиабет, гипертония, дислипидемия, обструктивное апноэ сна, сердечно-сосудистое заболевание).
ЭКСПЕРТНЫЕ КОММЕНТАРИИ
Если сравнивать эффективность CT-388, инъекционного GLP1RA/GIPRA, с коммерциализированным тирзепатидом и экспериментальным VK2735 авторства соответственно «Илай Лилли» и «Вайкинг терапьютикс» (Viking Therapeutics), которые обращаются к аналогичному двойному агонизму этих инкретинов, расклад получается следующим (приведены приблизительные значения, судя по графикам) [1] [2] [3].
За 12 и 24 недели лечения препарат-кандидат «Кармот» (22-мг доза) обеспечил уменьшение массы тела на 12,4% и 18,9% в абсолютном исчислении и на 11,5% и 18,8% в сравнении с плацебо. «Мунджаро» (15-мг доза) это сделал на абсолютных 9,1% и 14,8% и относительных 7,2% и 12,5%. За 12 недель лечения экспериментальный VK2735 (15-мг доза) снизил вес на абсолютных 13,9% и относительных 12,3%.
Таким образом, выходит, тройка инъекционных GLP1RA/GIPRA выстраивается в порядке уменьшения эффективности: VK2735 — CT-388 — тирзепатид.



Необходимо учитывать, что в случае CT-388 и VK2735 выход к целевой терапевтической дозе был осуществлен, согласно протоколам исследований, намного быстрее, чем при применении тирзепатида: начиная с соответственно 8-й и 10-й недель лечения — против 20-й.
Впрочем, справедливости ради, подобные сравнения методологически неверны ввиду различий в протоколах исследований и популяциях пациентов.
Что касается CT-996, перорального GLP1RA, обеспеченная им за 4 недели лечения разница с плацебо в потере веса на 6,1% (абсолютных 7,3%), выглядит конкурентноспособной, если учитывать, что пероральный семаглутид (50-мг доза) «Ново Нордиск» уменьшил массу тела на относительных 12,7% (абсолютных 15,1%) за 68 недель; пероральный орфорглипрон (orforglipron) [45-мг доза], разрабатываемый «Илай Лилли», снизил вес на относительных 10,6% и 12,4% (абсолютных 12,6% и 14,7%) за 26 и 36 недель; пероральный GSBR-1290 (120-мг доза), за которым стоит «Стракча терапьютикс» (Structure Therapeutics), привел к потере относительных 6,9% (абсолютных 6,4%) лишнего веса за 12 недель. Наконец, разрабатываемая «Вайкинг» пероральная рецептура VK2735 (40-мг доза), двойного агониста GLP1R/GIPR, определила похудение на уровне 3,3% относительно плацебо (абсолютных 5,3%) за 4 недели [4].

Structure Therapeutics: исключительно таблетки против ожирения
Мощные и безопасные лекарства для похудения — всё только начинается.
БИЗНЕС
«Кармот», основанная в 2008 году, за всё время своей самостоятельной работы получила инвестиционных вливаний на сумму $385 млн [1].
Ноу-хау «Кармот» завязано на фирменной платформе поиска лекарств Chemotype Evolution, которая была лицензирована у «Сунисис фармасьютикалс» (Sunesis Pharmaceuticals) в феврале 2010 года [2], а затем усовершенствована.
Большинство фармацевтических компаний ищут новые лекарства, осуществляя высокопроизводительный скрининг (HTS) библиотек из миллионов химических соединений. Поскольку эти соединения получены в результате предыдущих попыток поиска лекарств, они могут не содержать идеальных соединений для новых, более сложных задач.
Chemotype Evolution обращается к библиотеке синтетических фрагментов, собираемых вместе и проходящих итерационный процесс улучшения и оптимизации фармакологических характеристик. Получаемые низкомолекулярные или пептидные соединения и их гибриды способны таргетировать мишени, ранее считавшиеся недосягаемыми.
Процесс начинается с дизайна якорной молекулы, или «приманки», полученной из известных ингибиторов, субстратов, кофакторов, пептидов или хитов, отобранных в результате скрининга фрагментов. Затем «приманка» дериватизируется с помощью линкерного мотива, связывающего ее в индивидуальном порядке с каждым фрагментом из обширной коллекции «Кармот». В результате формируется библиотека из огромного числа гибридов «приманки» и фрагментов. Далее каждый гибрид проходит биофизическую или биохимическую проверку на связывание с мишенью. Наконец, из любых гибридов можно собрать любые другие гибриды, если это представляется релевантным и оптимальным.
Особую силу Chemotype Evolution придает возможность итераций: в отличие от традиционного HTS, когда статическая библиотека проверяется один раз против определенной мишени, в каждом цикле Chemotype Evolution создается новая библиотека.
В начале января 2014 года «Кармот» заключила партнерское соглашение с «Амджен» (Amgen) на предмет использования Chemotype Evolution [3] [4]. Итогом стал соторасиб (sotorasib), предназначенный для лечения местнораспространенного или метастатического немелкоклеточного рака легкого (НМРЛ) с мутацией KRASG12C, которая, как фармакологическая мишень, на протяжении четырех десятилетий считалась недостижимой. В конце мая 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) и в начале января 2022 года Европейское агентство по лекарственным средствам (EMA) одобрили соответственно «Лумакрас» (Lumakras, соторасиб) и «Лумикрас» (Lumykras, соторасиб).

«Лумакрас» / «Лумикрас»: новое лекарство против рака легкого с KRAS-мутацией
Соторасиб — таргетный препарат для лечения местнораспространенного или метастатического немелкоклеточного рака легкого с мутацией KRAS G12C.
В начале января 2023 года «Кармот» выделила Chemotype Evolution в самостоятельное предприятие — «Кимиа терапьютикс» (Kimia Therapeutics), которое пробует найти новые молекулы для лечения онкологических, иммунологических и воспалительных заболеваний [5].
Активы «Кармот» нужны «Рош» по нескольким причинам. Во-первых, гонка фармпроизводителей в стезе борьбы с ожирением затронула всех игроков отрасли, и было бы неправильным отказываться от соперничества, пусть даже напряженного и тяжелого, ведь это направление бизнеса сулит огромные барыши.
Во-вторых, наработки «Кармот» могут быть скомбинированы с экспериментами «Рош», касающимися похудения без потери мышечной массы — следующего этапа конкуренции, активно прорабатываемого в индустрии. В руках швейцарской фармкомпании есть экспериментальный RG6237 (RO7204239, GYM329) — разработанное японской «Шугай фармасьютикал» (Chugai Pharmaceutical) антитело, элиминирующее латентный миостатин из плазмы и тканей в целях сохранения и укрепления мышц.
В-третьих, «Рош» важно диверсифицировать и обновлять свой лекарственный портфель. В 2023 году предприятие заработало 60,44 млрд швейцарских франков (67,16 млрд долларов), из которых ₣44,61 млрд ($49,57 млрд) пришлись на продажи фармацевтической продукции, а ₣14,10 млрд ($15,67 млрд) — диагностической. Почти половина (43%) доходов от торговли лекарствами поступила со стороны онкологических препаратов, а треть (33%) денег принесли лекарства против неврологических и иммунологических расстройств. Всё бы ничего, но патентная защита рано или поздно падет, а продолжать наращивать обороты надо.
ТОЛСТАЯ НЕДАЛЬНОВИДНОСТЬ
В 2018 году, за три года до того, как «Вегови» вышел из стен «Ново Нордиск», став первым современным и мощным препаратом для лечения ожирения, «Рош» отказалась от сильной таблетки для похудения. Фармкомпания из Базеля не воспользовалась своим «правом преимущественного приобретения» экспериментального OWL833 для терапии СД2, разработанного «Шугай», с которой «Рош» дружит вот уже два десятилетия.

«Вегови»: новое и очень эффективное лекарство для похудения
Семаглутид поможет сбросить 15% лишнего веса за год. И даже больше.
Непептидный низкомолекулярный препарат-кандидат OWL833 был готов к началу клинических испытаний фазы I и оценивался лишь в несколько десятков миллионов долларов. В том же году его приобрела «Илай Лилли» (Eli Lilly) за авансовых $50 млн [1] — и в итоге он стал называться орфорглипроном (orforglipron, LY3502970).
Этот пероральный GLP1RA, успешно проходящий клиническую проверку в лечении ожирения и СД2, ожидается к регуляторному одобрению к 2026 году. Согласно отраслевым оценкам, у орфорглипрона есть потенциал заработать $50 млрд за шесть лет своей коммерческой доступности, а в 2032 году он доберется до отметки в $14,4 млрд годовых продаж.
Решение «Илай Лилли» поставить на орфорглипрон и профинансировать его доведение до ума наглядно демонстрирует, что крупнейшие игроки на рынке лечения СД2 располагают большим преимуществом в понимании особенностей метаболизма и потери веса, и потому способны принимать верные решения, пусть даже долгосрочные в своей конечной реализации.
В 2018 году научные знания о GLP-1 были относительно небогатыми, а ажиотажа вокруг снижения веса не было и в помине, равно как плотного изучения инкретинов для коррекции иных расстройств за пределами ожирения — так что расставленные «Рош» приоритеты вполне объяснимы.
Опять же, после неудавшихся в 2010 году позднестадийных испытаний таспоглутида (taspoglutide), экспериментального инъекционного еженедельного GLP1RA, лицензированного у французской «Ипсен» (Ipsen), — ввиду серьезных реакций гиперчувствительности и побочных ЖКТ-эффектов — «Рош» сократила инвестиции в диабет и ожирение, сосредоточившись на развитии противоракового портфеля [2] [3] [4].
Недальновидность свойственна всем. Так, «Пфайзер» (Pfizer) в конце 2022 года бесплатно передала «Телевант» (Televant) в составе «Ройвант сайенсиз» (Roivant Sciences) частичную лицензию на RVT-3101 (PF-06480605) — полностью человеческое моноклональное антитело против TNF-подобного лиганда 1A (TL1A), изучаемое в лечении воспалительных заболеваний кишечника. А уже через год «Рош» купила «Телевант» за $7,1 млрд [5].