ЧТО ПРОИЗОШЛО
«Тваймиг» (Twymeeg, имеглимин) — новый лекарственный препарат, предназначенный для лечения сахарного диабета 2-го типа (СД2) у взрослых.
ОСНОВНЫЕ ФАКТЫ
Имеглимин (imeglimin) — первый представитель совершенно нового класса гипогликемических лекарственных средств, названных глиминами (glimin).
Имеглимин идет с весьма благоприятным профилем безопасности: он лишен каких-либо серьезных нежелательных явлений, которыми характеризуются все без исключения нынешние лекарства, ориентированные на терапию СД2.
Назначение имеглимина не приводит к росту случаев гипогликемии: хотя препарат потенцирует функцию бета-клеток и секрецию инсулина, это лекарственное соединение вызывает выработку инсулина только в ответ на поступление глюкозы с пищей.
«Тваймиг», как и любой иной сахароснижающий лекарственный препарат, показан для применения на фоне соблюдения диеты и усиленной физической нагрузки.
Пероральный «Тваймиг» назначается по 1000 мг (две таблетки) утром и вечером (совокупно 2000 мг в день). В случае почечных нарушений доза корректируется в сторону снижения.
«Тваймиг» применяется как монотерапевтически, так и в комбинации с другими сахароснижающими препаратами.
«Тваймиг», разработанный французской «Поксел» (Poxel), одобрен в Японии в конце июня 2021 года под брендом ツイミーグ, и его продвижением занимается «Сумитомо фарма» (Sumitomo Pharma) [1].
В обозримом будущем появление имеглимина в других странах не предполагается.

СУТЬ ВОПРОСА
Сахарный диабет 2-го типа (СД2) — хроническое заболевание, которое характеризуется дисфункцией островковых бета-клеток поджелудочной железы и периферической инсулинорезистентностью, приводящей к гипергликемии.
Помимо необходимости в глубоком изменении образа жизни, подразумевающем соблюдение низкокалорийной диеты с усиленной физической активностью, для поддержания эффективного гликемического контроля обычно требуется фармакологическое лечение. Последнее, представленное обширным арсеналом лекарственных средств, сопровождается, как правило, рядом нежелательных явлений, особенно выраженных у пожилых. Вот почему по-прежнему не закрыта медицинская потребность в новых противодиабетических препаратах, безопасных и эффективных [1].
На первый взгляд, кажется, что для лечения СД2 предложено достаточно классов (одиннадцать) терапевтических соединений: каждый препарат, которых насчитывается шесть десятков [2], располагает уникальными механизмом действия, профилем безопасности, терапевтической эффективностью и способом применения. Однако чрезвычайно мало медикаментов, которые были бы нацелены на все патологические пути, ассоциированные с СД2. Вот почему, чтобы добиться должного гликемического контроля, обычно требуется комплексный подход, предполагающий назначение сразу нескольких сахароснижающих лекарственных средств.
Так, например, метформин, относящийся к классу бигуанидов и угнетающий образование глюкозы в печени (подавляет глюконеогенез), а также проявляющий множество иных, благоприятных при сахарном диабете эффектов, широко применяется в качестве первоочередной терапии СД2. Он эффективен, не приводит к набору массы тела и риску гипогликемии. Между тем некоторые пациенты вовсе не переносят распространенные желудочно-кишечные нежелательные явления (НЯ) метформина, проявляющиеся диареей, тошнотой, рвотой. Существует также малораспространенный риск лактатацидоза, особенно при нарушении функций печени или почек.
Стимуляторы выработки инсулина, такие как производные сульфонилмочевины и меглитиниды (глиниды), также часто назначают в рамках терапии первой линии СД2. Клиническая эффективность этих секретогенов инсулина не является долгосрочной, а сопутствующие гипогликемия и прибавка веса ограничивают их использование.
- Ацетогексамид, глибенкламид (глибурид), глиборнурид, глизоксепид, гликвидон, гликлазид, гликлопирамид, глимепирид, глипизид, глицикламид (толцикламид), карбутамид, метагексамид, толазамид, толбутамид, хлорпропамид;
- «ГлюкоНорм» / «НовоНорм» / «Прандин» / «Сурепост» / «Эниглид» (GlucoNorm / NovoNorm / Prandin / Surepost / Enyglid, репаглинид);
- «Глюфаст» (Glufast, митиглинид);
- «Старликс» (Starlix, натеглинид).
Тиазолидиндионам (глитазонам), повышающим чувствительность периферических тканей к инсулину и увеличивающим расход инсулинозависимой глюкозы, свойственны продолжительный сахароснижающий эффект и редкие случаи гипогликемии, но возможные отеки, рост массы тела, риски сердечной недостаточности и переломов костей сводят терапевтические преимущества на нет.
- «Актос» / «Глидипион» / «Глизон» / «Глустин» / «Зактос» / «Пиоглар» / «Пиоглит» / «Пиоз» (Actos / Glidipion / Glizone / Glustin / Zactos / Pyoglar / Pioglit / Pioz, пиоглитазон);
- «Авандия» (Avandia, росиглитазон);
- «Дьюви» (Duvie, лобеглитазон).
Ингибиторы альфа-глюкозидазы, действующие как конкурентные обратимые ингибиторы ферментов, необходимых для расщепления сложных углеводов, замедляют их всасывание в тонком отделе кишечника. Итоговый сахароснижающий эффект относительно слаб и краткосрочен. Среди наиболее распространенных НЯ: метеоризм, диарея, пневматоз кишечника, гипогликемия.
- «Воглиб» (Voglib, воглибоза);
- «Глисет» / «Диастабол» (Glyset / Diastabol, миглитол);
- «Глюкобай» / «Прандаза» / «Прекоза» (Glucobay / Prandase / Precose, акарбоза).
Относительно новыми классами противодиабетических лекарственных средств являются таргетированные на инкретины — метаболические гормоны, которые стимулируют снижение уровня глюкозы в крови. Так, агонисты рецептора глюкагоноподобного пептида-1 (GLP1R) редко ассоциированы с гипогликемией, стимулируют рост бета-клеток поджелудочной железы, ингибируют глюкагон, индуцируют уверенное снижение массы тела, подавляют аппетит и замедляют процесс эвакуации желудочного содержимого. Агонисты GLP1R значительно снижают риски сердечно-сосудистых осложнений и прогрессирования диабетической нефропатии. Большинство пациентов сталкиваются с НЯ со стороны желудочно-кишечного тракта: тошнотой, рвотой, диареей, запором, болью в животе — обычно с легко-умеренной степенью выраженности и, как правило, только в начале лечения.
- «Адликсин» / «Ликсумия» (Adlyxin / Lyxumia, ликсисенатид);
- «Баета» (Byetta, эксенатид);
- «Бидуреон» / «Баета Лонг» (Bydureon / Byetta Long, эксенатид);
- «Виктоза» (Victoza, лираглутид);
- «Мунджаро» (Mounjaro, тирзепатид);
- «Оземпик» (Ozempic, семаглутид);
- «Ребелсас» (Rybelsus, семаглутид);
- «Танзеум» / «Эперзан» (Tanzeum / Eperzan, албиглутид);
- «Трулисити» (Trulicity, дулаглутид).
Параллельно агонистам GLP1R идут ингибиторы дипептидилпептидазы-4 (DPP4), или глиптины, которые подавляют активность одноименного фермента, разрушающего инкретины. Препараты этого класса не характеризуются серьезными НЯ, но не слишком хорошо справляются с задачей снижения уровня глюкозы в крови.
- «Бэй Чжан Пин» (Bei Zhang Ping, 倍长平, кофроглиптин);
- «Галвус» / «Ксилиаркс» / «Ялра»(Galvus / Xiliarx / Jalra, вилдаглиптин);
- «Земигло» (Zemiglo, гемиглиптин);
- «Зафатек» / «Ведика» (Zafatek / Wedica, трелаглиптин);
- «Жуй Цзэ Тан» (Rui Ze Tang, 瑞泽唐, ретаглиптин);
- «Маризев» (Marizev, омариглиптин);
- «Несина» / «Випидия» (Nesina / Vipidia, алоглиптин);
- «Онглиза» (Onglyza, саксаглиптин);
- «Сатерекс» (Saterex, гозоглиптин);
- «Суганон» / «Эводин» (Suganon / Evodine, эвоглиптин);
- «Суини» (Suiny, анаглиптин);
- «Тенелия» (Tenelia, тенелиглиптин);
- «Траджента» / «Тражента» (Tradjenta / Trajenta, линаглиптин);
- «Янувия» / «Тесавел» / «Кселевиа» (Januvia / Tesavel / Xelevia, ситаглиптин).
Ингибиторы натрий-глюкозного котранспортера 2-го типа (SGLT2), или глифлозины, блокируют обратный захват глюкозы в почечных канальцах, тем самым способствуя ее потере с мочой. Они весьма эффективны, равно как снижая уровень сахара в крови, так и предупреждая сердечно-сосудистые осложнений и сдерживая прогрессирование почечной недостаточности, но могут приводить к развитию кетоацидоза, инфекциям урогенитального тракта, кандидозному вульвовагиниту.
- «Аплевей» / «Деберза» (Apleway / Deberza, тофоглифлозин);
- «Брензави» (Brenzavvy, бексаглифлозин);
- «Джардинс» (Jardiance, эмпаглифлозин);
- «Жуй Цинь» (Rui Qin, 瑞沁, хенаглифлозин);
- «Инвокана» (Invokana, канаглифлозин);
- «Инпефа» / «Зинквиста» (Inpefa / Zynquista, сотаглифлозин);
- «Люсефи» (Lusefi, люсеоглифлозин);
- «Ремо» / «Ремозен» (Remo / Remozen, ремоглифлозин);
- «Стеглатро» (Steglatro, эртуглифлозин);
- «Суглат» (Suglat, ипраглифлозин);
- «Фарсига» / «Форсига» (Farxiga / Forxiga, дапаглифлозин);
- «Хуэй Юцзин» (Huiyoujing, 惠优静, ганаглифлозин [янаглифлозин]).
Агонисты рецептора амилина влияют на контроль над уровнем глюкозы посредством замедления опорожнения желудка, подавления постпрандиального подъема глюкагона, снижения потребления пищи. Аналоги амилина, пептида, который секретируется совместно с инсулином из бета-клеток, не оказывают, в отличие от агонистов GLP1R, инсулиносекреторного действия. Среди частых НЯ: тошнота, рвота, головная боль. На фоне инсулинотерапии резко возрастает риск гипогликемии.
- «Симлин» (Symlin, прамлинтид).
Агонисты дофаминового D2-рецептора, изначально разработанные для лечения пролактиномы и опухолей гипофиза, применяют в терапии СД2. Их назначение в течение 2 часов после пробуждения приводит к повышению чувствительности к инсулину, росту утилизации глюкозы, а также снижению гипергликемии натощак и после еды в течение дня, причем без повышения уровня инсулина. Среди прочего: уменьшение массы тела и снижение эндогенной выработки глюкозы печенью. Распространенные НЯ включают тошноту, ортостатическую гипотензию, головные боли, рвоту.
- «Сиклосет» (Cycloset, бромокриптин).
Секвестранты жёлчных кислот предназначены для снижения уровня холестерина липопротеинов низкой плотности (ЛПНП), но благодаря их способности улучшать гликемический контроль иногда их назначают в ходе лечения СД2. Наиболее распространены такие НЯ, как вздутие живота, запор, изжога, боль в животе.
- Колесевелам.
Наконец, непосредственно инсулиновая терапия — самая мощная для контроля над уровнем глюкозы — характеризуется существенными рисками гипогликемии и увеличения веса.
БОЛЬШИЕ ЧИСЛА
Согласно оценкам Международной диабетической федерации (IDF), в 2021 году каждый десятый взрослый человек в мире (10,5%, или 537 млн) страдал сахарным диабетом (СД), причем почти половина не были осведомлены о своем состоянии [1].
По подсчетам Всемирной организации здравоохранения (ВОЗ), если в 1990 году в мире насчитывалось 200 млн больных СД (7% взрослого населения Земли), то в 2022 году их число выросло до 830 млн человек (14%). Свыше половины (59%) диабетиков в возрасте 30 лет и старше не принимают никаких сахароснижающих лекарственных препаратов [2].
В 2021 году СД стал непосредственной причиной 1,6 млн смертельных исходов, плюс 530 тыс. летальных исходов были обусловлены диабетической нефропатией, а высокий уровень глюкозы в крови был ответственен за 11% смертей от осложнений сердечно-сосудистых заболеваний.
В 90–95% случаев диабета речь идет о сахарном диабете 2-го типа.
КАК ЭТО РАБОТАЕТ
Имеглимин (imeglimin, PXL008, EMD-387008, RVT-1501) — первый представитель совершенно новых лекарственных соединений, содержащих тетрагидротриазин (tetrahydrotriazine) и названных глиминами (glimin).
Структурно имеглимин напоминает метформин.
Механизм действия имеглимина отличается от существующих гипогликемических препаратов и направлен на биоэнергетику митохондрий и улучшение их функций. Имеглимин представляет собой пероральный низкомолекулярный блокатор окислительного фосфорилирования, модулирующий деятельность комплекса митохондриальной дыхательной цепи и уменьшающий образование реактивных форм кислорода.



Имеглимин оказывает благотворное влияние на три основных патофизиологических компонента сахарного диабета 2-го типа (СД2), которые проявляются недостаточностью секреции инсулина с усиленным апоптозом бета-клеток поджелудочной железы, чрезмерным глюконеогенезом гепатоцитами, нарушением усвоения глюкозы периферическими инсулиночувствительными тканями (скелетной мускулатурой) [1] [2].
Механизм действия имеглимина представлен двойным эффектом: во-первых, усилением стимулированной глюкозой секреции инсулина и сохранением массы бета-клеток, во-вторых, усилением действия инсулина, включая потенциал для ингибирования печеночной выработки глюкозы и улучшения сигнализации инсулина в печени и скелетных мышцах [3].



На клеточном и молекулярном уровне действие имеглимина реализуется за счет коррекции митохондриальной дисфункции — общего базового элемента патогенеза СД2 [2] [3] [4].
Так, наблюдается восстановление баланса активности дыхательной цепи (частичное ингибирование митохондриального комплекса I и коррекция недостаточной активности митохондриального комплекса III), что приводит к снижению образования реактивных форм кислорода (снижение окислительного стресса) и подавлению открытия митохондриальной поры переходной проницаемости (mPTP) [предотвращение гибели эндотелиальных клеток]. Последний эффект происходит без ингибирования митохондриального дыхания, что свидетельствует о потенциальной возможности защиты конечных органов, например почек и сердца.
К слову, метформин схожим образом подавляет митохондриальный комплекс I [5] [6].
Имеглимин усиливает стимулированное глюкозой производство АТФ и вызывает синтез никотинамидадениндинуклеотида (NAD+) по «пути спасения». Помимо ключевой роли в качестве митохондриального кофактора, метаболиты NAD+ способствуют увеличению стимулированной глюкозой секреции инсулина (посредством усиленной мобилизации Ca2+).
Имеглимин предотвращает потерю функциональной массы бета-клеток: за счет умеренного роста пролиферации бета-клеток и сдерживания их апоптотической гибели, обычно наблюдаемой при глюкотоксичности и липотоксичности в условиях СД2 [7] [8].

Благодаря улучшению митохондриальной функции в гепатоцитах имеглимин снижает стеатоз печени, подавляет апоптоз гепатоцитов, сдерживает развитие фиброза печени, а также подавляет липогенез de novo и усиливает окисление жирных кислот [9] [10].
В целом имеглимин направлен на ключевую первопричину СД2: дефекты клеточного энергетического метаболизма.

КЛИНИЧЕСКИЕ ПОДРОБНОСТИ
Для оценки эффективности и безопасности имеглимина в лечении сахарного диабета 2-го типа (СД2) у взрослых (в возрасте 20 лет и старше) пациентов (>1000) из Японии была осуществлена клиническая программа TIMES из трех опорных исследований фазы III:
- TIMES 1 (JapicCTI-173769, jRCT2080223713): 24-недельное клиническое испытание (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое), проверившее моноприменение имеглимина;
- TIMES 2 (JapicCTI-173782, jRCT2080223726): 52-недельное клиническое испытание (рандомизированное, открытое, плацебо-контролируемое, многоцентровое), изучившее мононазначение имеглимина или его применение на фоне других противодиабетических препаратов, включая производные сульфонилмочевины, глиниды, метформин, ингибиторы альфа-глюкозидазы, глитазоны, DPP4-ингибиторы, GLP1R-агонисты, SGLT2-ингибиторы;
- TIMES 3 (JapicCTI-183846, jRCT2080223790): 16-недельное клиническое испытание (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое) с последующим 36-недельным открытым периодом, протестировавшее добавление имеглимина к инсулинотерапии с недостаточным ответом на нее.
TIMES 1
Клиническое исследование TIMES 1 привлекло пациентов (n=212), придерживающихся диеты и физической нагрузки. Исходный уровень гликированного гемоглобина (HbA1c) находился в пределах 7,0–10%.
Участникам назначали по 1000 мг имеглимина два раза в день или плацебо.
По прошествии 24 недель лечения уровень HbA1c в группе имеглимина снизился на усредненных 0,72% (95% ДИ [здесь и далее]: −0,86,−0,58) — против его роста на 0,15% (+0,01, +0,29) в группе плацебо: разница составила −0,87% (−1,04, −0,69; p<0,0001) [1].

К целевому уровню HbA1c ниже 7% вышли 36% пациентов, получавших имеглимин, — против 8% в контрольной группе (p<0,0001).
Среди испытуемых, ранее не лечивших диабет, уровень HbA1c упал на усредненных 0,81% (−0,96, −0,67) — против его роста на 0,06% (−0,08, +0,20): разница получилась равной −0,87% (−1,07, −0,67; p<0,0001). Среди пациентов, которые прежде лечили диабет, уровень HbA1c снизился на усредненных 0,51% (−0,73, −0,29) — против его подъема на 0,33% (+0,09, +0,56): разница составила −0,84% (−1,16, −0,52; p<0,0001).
Абсолютное снижение уровня HbA1c было больше среди пациентов, которые ранее не придерживались фармакотерапии СД2. Возможно, имеглимин лучше подходит такой категории больных благодаря своей способности улучшать стимулированную глюкозой секрецию инсулина при не слишком масштабной гибели бета-клеток.
Прочие клинические исходы следующие:
- Глюкоза в плазме натощак (FGP): изменение на −0,31 ммоль/л в группе имеглимина — против +0,71 ммоль/л в группе плацебо (p<0,0001).
- Соотношение проинсулина к инсулину натощак: изменение на −0,0138 — против +0,0036 (p=0,0579). Рост данного соотношения отражает дисфункцию бета-клеток, связанную с возникновением и прогрессированием СД2.
- Соотношение проинсулина к C-пептиду натощак: изменение на −0,0003 — против +0,0002 (p=0,0012). Рост данного соотношения считается лучшим индикатором нарушенного состояния бета-клеток, поскольку C-пептид не проходит печеночный клиренс, то есть его концентрация меньше зависит от инсулинорезистентности.
- Количественный индекс контроля чувствительности к инсулину (QUICKI): изменение на +0,0017 — против −0,0076 (p=0,0050). Чем ниже данный показатель, определяемый обратной суммой логарифмов инсулина и глюкозы натощак, тем больше инсулинорезистентность.
- Индекс инсулинорезистентности согласно модельной оценке гомеостаза (HOMA-IR): изменение на +0,1961 — против +0,1321 (p=0,7325).
- Индекс бета-клеточной функции согласно модельной оценке гомеостаза (HOMA-β): изменение на +3,5276 — против −2,7121 (p=0,0002).
- Уровень общего холестерина вырос на 3,3% в группе имеглимина по сравнению с группой плацебо (p=0,0439), уровень холестерина липопротеинов низкой плотности (ЛПНП) увеличился на 7,2% (p=0,0051). Различия не имели клинической значимости.

Профиль безопасности имеглимина благоприятствовал. Пропорции испытуемых, столкнувшихся с нежелательными явлениями (НЯ), были схожими в группах препарата и плацебо. Не отмечено серьезных НЯ, которые были бы связаны с лечением. Засвидетельствована приемлемая переносимость имеглимина: очень редкие недомогания со стороны желудочно-кишечного тракта носили легкую степень выраженности.
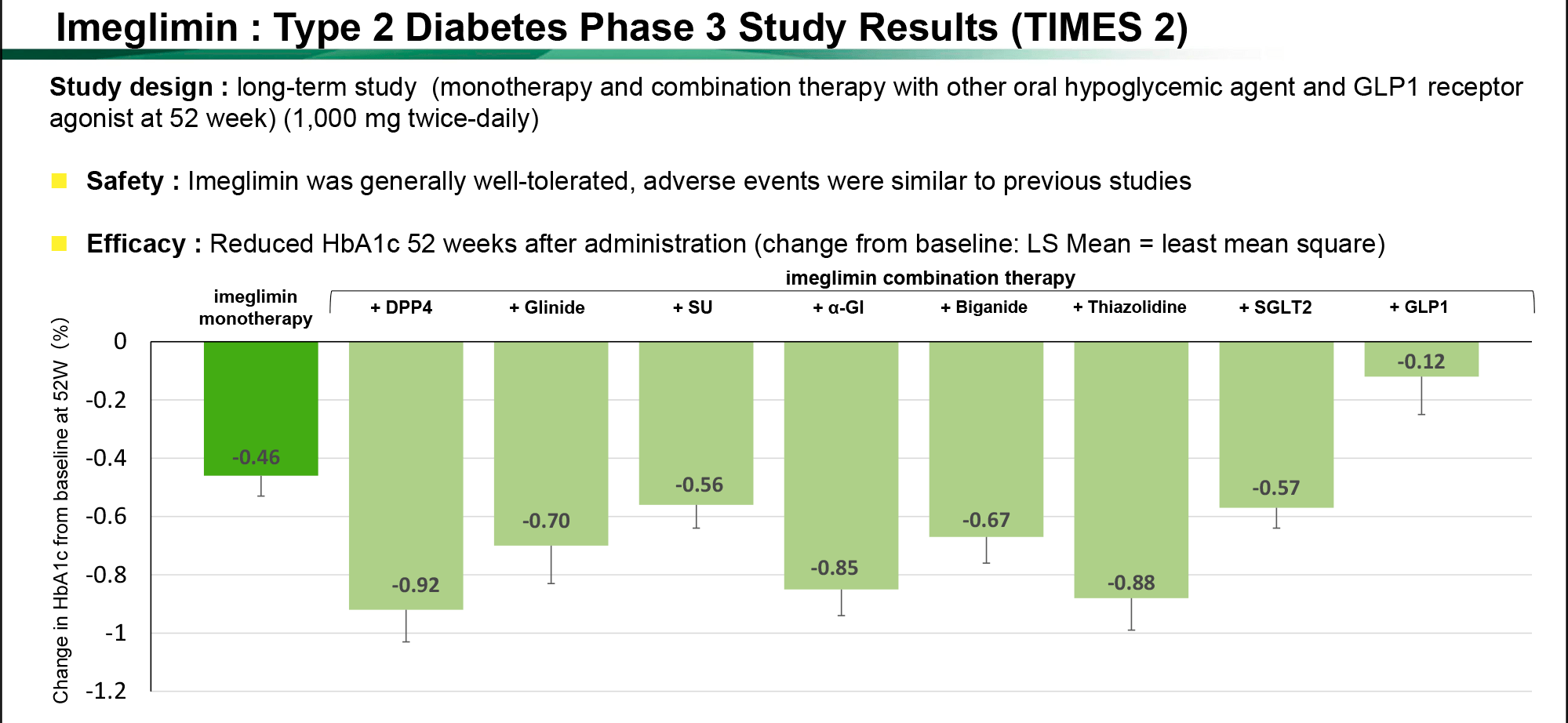
TIMES 2
Клиническое исследование TIMES 2 пригласило пациентов (n=714), исходный уровень HbA1c которых находился в диапазоне 7,0–10% или 7,5–10,5% — соответственно в случае монотерапии или комбинированного лечения.
Участникам назначали по 1000 мг имеглимина два раза в день или его же на фоне других противодиабетических лекарственных средств.
По истечении 52 недель лечения результаты получились следующими [1]:
- моноприменение имеглимина снизило уровень HbA1c на 0,46% (95% ДИ [здесь и далее]: −0,59, −0,33);
- сочетание имеглимина с DPP4-ингибиторами: −0,92% (−1,14, −0,71);
- сочетание имеглимина с глитазонами: −0,88% (−1,10, −0,67);
- сочетание имеглимина с ингибиторами альфа-глюкозидазы: −0,85% (−1,03, −0,67);
- сочетание имеглимина с глинидами: −0,70% (−0,95, −0,45);
- сочетание имеглимина с метформином: −0,67% (−0,86, −0,48);
- сочетание имеглимина с SGLT2-ингибиторами: −0,57% (−0,71, −0,43);
- сочетание имеглимина с производными сульфонилмочевины: −0,56% (−0,71, −0,40);
- сочетание имеглимина с GLP1R-агонистами: −0,12% (−0,39, −0,15).

TIMES 3
Клиническое исследование TIMES 3 охватило пациентов (n=208), придерживающихся инсулинотерапии. Исходный уровень HbA1c находился в пределах 7,5–11,0%.
В двойной слепой 16-недельный период лечения участникам на фоне привычной им инсулинотерапии назначали по 1000 мг имеглимина два раза в день или плацебо.
В группе имеглимина отмечено снижение уровня HbA1c на усредненных 0,63% (95% ДИ [здесь и далее]: −0,78, −0,49) — против его снижения на 0,03% (−0,18, +0,12) в группе плацебо: разница составила 0,60% (−0,80, −0,40; p<0,0001) [1].
К уровню HbA1c ≤ 7,0% вышли 7,4% человек — против 0,9% (p=0,045).
В последовавшем открытом 36-недельном периоде лечения все испытуемые получали вышеуказанную дозу имеглимина вместе с инсулинотерапией.
Те участники, которые изначально следовали курсом имеглимина, продемонстрировали снижение уровня HbA1c на усредненных 0,64% (−0,82, −0,46) относительно исходного. У пациентов, которым назначили имеглимин после плацебо, данное падение составило усредненных 0,54% (−0,71, −0,38) по отношению к исходному.
Уровень HbA1c ≤ 7,0% был достигнут среди 8,3% пациентов — против 0,9% (p=0,045).



Профиль безопасности имеглимина характеризовался приемлемой переносимостью, серьезных побочных реакций, связанных с лечением, не зарегистрировано. Частоты гипогликемических событий были одинаковыми в двух группах, никакое из них не привело к прекращению лечения. Не зафиксировано никаких клинически значимых изменений в лабораторных показателях, физических параметрах (масса тела), сердечно-сосудистых оценках (артериальное давление).
ЧТО ДАЛЬШЕ
Имеглимин продолжает тщательно изучаться в различных популяциях пациентов с сахарным диабетом 2-го типа (СД2). Клинические испытания, в основном небольшие по охвату, призваны уточнить и углубить понимание механизма действия препарата, обнаружить его дополнительные полезные свойства, упрочить доказательную базу профиля безопасности:
- DIGNITY (jRCTs031210623): пациенты (n=575) с ранее нелеченным СД2 — изучение устойчивости гликемического контроля в ходе трехлетней пероральной терапии имеглимином, метформином или вилдаглиптином;
- FAMILIAR (jRCTs061210082): пациенты (n=200) с недостаточным гликемическим контролем, несмотря на назначение DPP4-ингибитора, — эффект имеглимина на уровень глюкозы в крови;
- jRCT1011220005: пациенты (n=70), получающие DPP4-ингибитор и метформин, — эффект имеглимина на гликемический контроль в сравнении с увеличением дозы метформина;
- jRCT1041220023: пациенты (n=30) — влияние имеглимина на активность симпатических нервов мышц путем оценки частоты спайков;
- Paradime-TIR (jRCTs051220061): пациенты (n=60) — влияние имеглимина на вариабельность уровня глюкозы в крови путем оценки времени в диапазоне (TIR);
- jRCTs051220075: пациенты (n=40) — эффективность имеглимина и метформина в отношении секреции инсулина и резистентности к нему;
- IMELD (jRCTs051220094): пациенты (n=27) с метаболически ассоциированной стеатозной болезнью печени (МАСБП) — снижение уровня АЛТ;
- INFINITY (jRCTs031220489): пациенты (n=30), получающие только ингибитор альфа-глюкозидазы и/или метформин, — клинические маркеры гипогликемии и влияние на эритроциты;
- ABCD-TO-SEIZE (jRCTs051220187): пациенты (n=87) с ранее нелеченным СД2 — улучшение функции бета-клеток поджелудочной железы при пероральном назначении имеглимина, семаглутида или тофоглифлозина, согласно индексу распределения глюкозы;
- IMCAP-HF (jRCTs031220712): пациенты (n=44) с сердечной недостаточностью — повышение физической работоспособности на базе изменения пикового потребления кислорода;
- jRCT1061230069: пациенты (n=100) — оценка антиоксидантного и ренопротекторного эффектов имеглимина в сравнении с эмпаглифлозином, согласно изменениям уровней 8-OH-дезоксигуанозина (8-OHdG) и белка 1, связывающегося с жирными кислотами (FABP1);
- MEGMI-QOL (jRCT1011240025): пациенты (n=36), придерживающиеся инсулинотерапии, — добавление имеглимина к инсулину с одновременным устранением (или снижением) болюсной дозы последнего;
- jRCT1031240269: пациенты (n=30) с СД2, осложненным циррозом печени (гепатогенный сахарный диабет).
ЭКСПЕРТНЫЕ КОММЕНТАРИИ
К моменту дебютного внедрения имеглимина в клиническую практику Японии «Сумитомо» исходила, что оно будет осуществляться в виде комбинации этого препарата с другими противодиабетическими лекарствами. И на это есть причины [1]. Во-первых, имеглимин особенно хорошо себя показал в сочетании с DPP4-ингибиторами. Во-вторых, именно DPP4-ингибиторы (а не метформин) более чем популярны в Японии: к ним обращается почти половина прежде нелечившихся пациентов с сахарным диабетом 2-го типа (СД2) [2].
Если говорить о назначении имеглимина в качестве препарата первой линии, для этого есть все шансы, поскольку японцы всё чаще сталкиваются с недостаточной секрецией инсулина и инсулинорезистентностью ввиду продолжающегося проникновения в их рацион пищи, которую обычно едят на Западе (так называемая вестернизация).
Основной маркетинговый упор фармкомпания из Осаки должна была делать на на пожилых пациентов с СД2: ввиду более чем приемлемого профиля безопасности имеглимина, не вызывающего каких-либо серьезных нежелательных явлений (НЯ), критичных для данной популяции возрастных больных.
Сейчас «Тваймиг» официально не рекомендован при умеренно-тяжелой почечной недостаточности (при оценочной скорости клубочковой фильтрации [eGFR] < 45 мл/мин/1,73 м2) ввиду возможного резкого повышения концентрации препарата в крови. Однако фармакокинетическое исследование установило, что снижение дозы имеглимина до 500 мг дважды в день вполне пригодно для лечения пациентов с eGFR в диапазоне 15–45 мл/мин/1,73 м2. Больным с терминальной стадией почечной недостаточности (eGFR < 15 мл/мин/1,73 м2) подойдет доза имеглимина 500 мг через день (или еще реже) [3].
Последовавшая постмаркетинговая проверка TWINKLE (jRCT2041210115) фазы IV сделала заключение о приемлемой безопасности назначения имеглимина в дозе 500 мг два раза в день и 500 мг один раз в день при eGFR от 15 до 40 мл/мин/1,73 м2 и менее 15 мл/мин/1,73 м2 соответственно. Собранные данные отправлены в адрес регулятора в целях дополнения инструкции по медицинскому применению лекарственного препарата «Тваймиг» [4].
Клиническое испытание TIMES 1 выяснило, что терапевтическая эффективность имеглимина относительно плацебо в целом не зависит от того, лечились ли пациенты от СД2 ранее или нет. Хотя абсолютный уровень снижения глюкозы в крови был более выражен среди прежде не проходивших терапию, что, возможно, объясняется, во-первых, менее запущенной формой диабета у таких пациентов, и, во-вторых, недостаточным по длительности 12-недельным отмывочным периодом среди уже лечившихся.
Ввиду незначительного роста частоты НЯ со стороны желудочно-кишечного тракта в ответ на назначение имеглимина в дозе 1500 мг дважды в день, было принято решение в дальнейшем уменьшить ее до 1000 мг дважды в день.
Клиническое испытание TIMES 2 показало, что имеглимин оказывает клинически значимый эффект снижения уровня глюкозы в крови независимо от класса препаратов, с которыми он комбинируется. Хотя добавление агонистов GLP1R стало исключением: отмечалась весьма скромная аддитивная эффективность. Это связано, есть мнение, с несколькими факторами.
Во-первых, когорта пациентов, получавших агонисты GLP1R, характеризовалась большей тяжестью заболевания, и потому масса бета-клеток, очевидно, была снижена. Во-вторых, сигнальные пути, опосредованные имеглимином и агонистами GLP1R, в конечном итоге сходятся, что отражается ослабленной способностью имеглимина стимулировать высвобождение инсулина в ответ на поступление глюкозы с пищей.
Напротив, добавление к имеглимину ингибиторов DPP4 оказало наиболее выраженный сахароснижающий эффект. Это стало результатом, скорее всего, удачного с терапевтической точки зрения сочетания разных механизмов действия, дополняющих друг друга без блокирования или пересечения.
Клиническое испытание TIMES 3 подтвердило оправданность добавления имеглимина к инсулинотерапии. Поскольку СД2 является прогрессирующим заболеванием, характеризующимся нарастающим ухудшением функции бета-клеток поджелудочной железы, есть мнение, что включенные в исследование пациенты сохранили остаточную массу бета-клеток (хотя их диабет продолжался в среднем 13,3 года), и это повлекло за собой пользу в виде усиления стимулированной глюкозой секреции инсулина.
Что примечательно, добавление имеглимина улучшило гликемический контроль без необходимости интенсификации инсулинотерапии: либо путем увеличения базальной дозы инсулина, либо посредством добавления прандиальных доз инсулина короткого действия.
Благодаря отсутствию каких-либо серьезных НЯ добавление имеглимина к инсулинотерапии может принести пользу пожилым пациентам, поскольку у возрастных больных зачастую присутствуют функциональные ограничения (к примеру, трудности с точным введением инсулина), сопутствующие заболевания, недостаточная социальная поддержка.
Следует понимать, что результаты TIMES 3 нельзя безоговорочно распространять на мировую популяцию диабетиков. Пациенты азиатского происхождения отличаются от больных СД2 другого этноса: они характеризуются выраженной дисфункцией бета-клеток, уменьшенной адипозностью, сниженной инсулинорезистентностью. Известно, что на азиатов препараты, стимулирующие функцию бета-клеток, такие как ингибиторы DPP4 и агонисты GLP1R, оказывают больший глюкозоснижающий эффект по сравнению с людьми из других этнических групп [5] [6].
БИЗНЕС
Начало интенсивной разработки имеглимина было положено в 2009 году, когда «Поксел» (Poxel) отделилась от немецкой «Мерк КГаА» (Merck KGaA), которая, следуя курсом реструктуризации после поглощения швейцарской «Сероно» (Serono), решила вывести метаболический бизнес в автономное предприятие [1].
Коммерческой реализацией имеглимина в Японии (а также в Китае, Южной Корее и ряде государств Юго-Восточной Азии, если он там будет одобрен) занимается японская «Сумитомо фарма» (Sumitomo Pharma), которая до начала апреля 2022 года называлась «Сумитомо Даиниппон фарма» (Sumitomo Dainippon Pharma).
Соответствующее соглашение между «Поксел» и «Сумитомо», заключенное в конце октября 2017 года, предполагало, что вторая заплатит первой авансом $42 млн плюс потенциальных $257 млн по мере развития проекта и продаж готового препарата, а также будет выдавать двузначное роялти от его реализации [2]. Часть денег отходит оригинатору в лице «Мерк КГаА».
В феврале 2018 года «Ройвант сайенсиз» (Roivant Sciences) лицензировала имеглимин, чтобы продвигать его в США, Европе и других странах, не относящихся к сделке с «Сумитомо». За это «Поксел» получила авансом $50 млн и обещания будущих выплат до $600 млн плюс роялти от продаж.
В ноябре 2020 года «Метавант» (Metavant), которую «Ройвант» специально создала под разработку имеглимина, вернула «Поксел» права на препарат по причине изменившейся стратегии развития [3]. Таким образом, появление имеглимина на Западе пока под большим вопросом: «Поксел» однозначно нуждается в финансово сильных партнерах, чтобы провести должные регистрационные клинические испытания.
Ну а пока объемы торговли имеглимином назвать серьезными не получается. В финансовом 2022 году, закрывшемся в конце марта 2023-го, продажи имеглимина в Японии составили 2,2 млрд иен (€15 млн) [4]. В финансовом 2023 году реализация препарата обозначилась в объеме 4,6 млрд иен (€27,9 млн). В финансовом 2024 году сбыт, как прогнозируется, доберется до 11,3 млрд иен (€69,1 млн) [5].
Отраслевые прогнозы, сделанные на момент рыночного дебюта имеглимина, сводились к выходу на уровень продаж 14,3 млрд иен ($95,5 млн) на 10-й год коммерческой доступности препарата [6].
Если имеглимину всё же удастся выйти на мировую арену, его пиковые продажи могут взлететь до $3 млрд, из которых $600 млн будут поступать со стороны Японии: международный успех препарата подстегнет внутренний спрос.
Медленный, но уверенный рост интереса к имеглимину обусловлен непрекращающимися усилиями «Сумитомо», фармпредставители которой более чем агрессивно продвигают этот препарат среди врачей, которые в свою очередь подталкивают пациентов.
Однако, учитывая всё еще скромный спрос на имеглимин, бизнес-позиции «Поксел» не выглядят устойчивыми. Вот почему в конце сентября 2024 года ей пришлось поделиться частью своего роялти с инвестиционной «Орбимед» (OrbiMed), чтобы закрыть нуждающиеся в погашении долговые обязательства [7].
В конце октября 2022 года имеглимин появился в Индии [8], где местные производители генерических лекарств наладили выпуск его копий под такими, к примеру, названиями, как «Зуглимин» (Zuglimin), «Имег-CKD» (Imeg-CKD), «Имеглимон» (Imeglimon), «Имеглин» (Imeglyn), «Имеземик» (Imezemic), «Имекласс» (Imeclass), «Имекстор» (Imextor), «Именорм» (Imenorm), «Имецин» (Imecin), «Имиглин» (Imiglin), «Имиглинол» (Imiglinol), «Инзобун» (Inzoboon), «Люпимег» (Lupimeg).
