РЕЗЮМЕ
- Будущее лечения онкологических заболеваний принадлежит персонализированным противораковым вакцинам.
- Такие вакцины изготавливаются очень быстро и сообразно опухолевой специфике каждого конкретного пациента.
- Первая индивидуализированная онковакцина, придерживающаяся концепции прецизионной медицины, появится в 2025 году.
- Уже продемонстрировано успешное лечение меланомы и рака головы и шеи.
- На очереди — рак легкого, рак почки, рак мочевого пузыря, немеланомный рак кожи.
ЧТО ПРОИЗОШЛО
«Модерна» (Moderna) в сотрудничестве с «Мерк и Ко» (Merck & Co.) разработала mRNA-4157 (V940) — персонализированную противораковую вакцину, которая производится отдельно под каждого пациента с четким прицелом на специфику его заболевания.
На данном этапе собраны весьма обнадеживающие клинические результаты лечения прошедшей хирургическую резекцию меланомы, превосходящие стандартную терапию.
Продемонстрированы примечательные исходы лечения неоперабельного рака головы и шеи. Продолжается клиническая проверка терапии рака легкого, рака почки, рака мочевого пузыря, немеланомного рака кожи.
Механистическое обоснование концепции персонализированных противораковых вакцин выглядит разумным и состоятельным. Мол, они запускают доселе невиданный мощный противоопухолевый иммунный ответ, причем высокоспецифичный, учитывающий особенности онкопатологии каждого конкретного пациента. Но пока шквал потенциально благотворных T-клеточных реакций не превратится в устойчивую и продолжительную клиническую ремиссию, будущего у противораковых вакцин попросту нет. И здесь обломали зубы десятки и сотни разработчиков. Но у «Модерна», кажется, получилось.
Если всё и дальше будет идти по плану, индивидуализированная неоантигенная мРНК-онковакцина mRNA-4157 (V940) получит ускоренное регуляторное одобрение в 2025 году.
Относительно несложный процесс выпуска и применения mRNA-4157 (V940) идет вразрез с комплексным и дорогостоящим производственным циклом и назначением терапии T-клетками с химерным антигенным рецептором (CAR), препараты на базе которой стали настоящим прорывом в лечении запущенных онкогематологических заболеваний.
Тем временем явных успехов добилась немецкая «Байонтек» (BioNTech). Персонализированная противораковая мРНК-вакцина аутоген цевумеран (autogene cevumeran), изучаемая совместно с «Дженентек» (Genentech) в составе «Рош» (Roche), весьма достойно показала себя в лечении рака поджелудочной железы.
Аутоген цевумеран: мРНК-вакцина против рака поджелудочной железы
Персонализированная иммунотерапия обеспечила уверенное продление жизни для трети пациентов с протоковой аденокарциномой поджелудочной железы.
МЕХАНИЗМ ДЕЙСТВИЯ
mRNA-4157 (V940) представляет собой персонализированную противораковую вакцину, которая, следуя концепции прецизионной медицины, должна резко улучшить эффективность лечения онкологических заболеваний.
Из опухолей и образцов крови пациента выделяют только ему свойственные неоантигены — антигены, закодированные мутантными генами, специфичными для раковых клеток в данных новообразованиях (последние развиваясь и прогрессируя, мутируют в обязательном порядке). При этом в состав онковакцины входят равно как эпитопы неоантигенов, которые были обнаружены в ходе ex vivo экспериментов над иммунными клетками пациента, так и эпитопы неоантигенов из всего экзома, которые, согласно прогностическому биоинформационному алгоритму, являются иммуногенными, то есть способными запустить в организме благотворные иммуностимулирующие реакции.
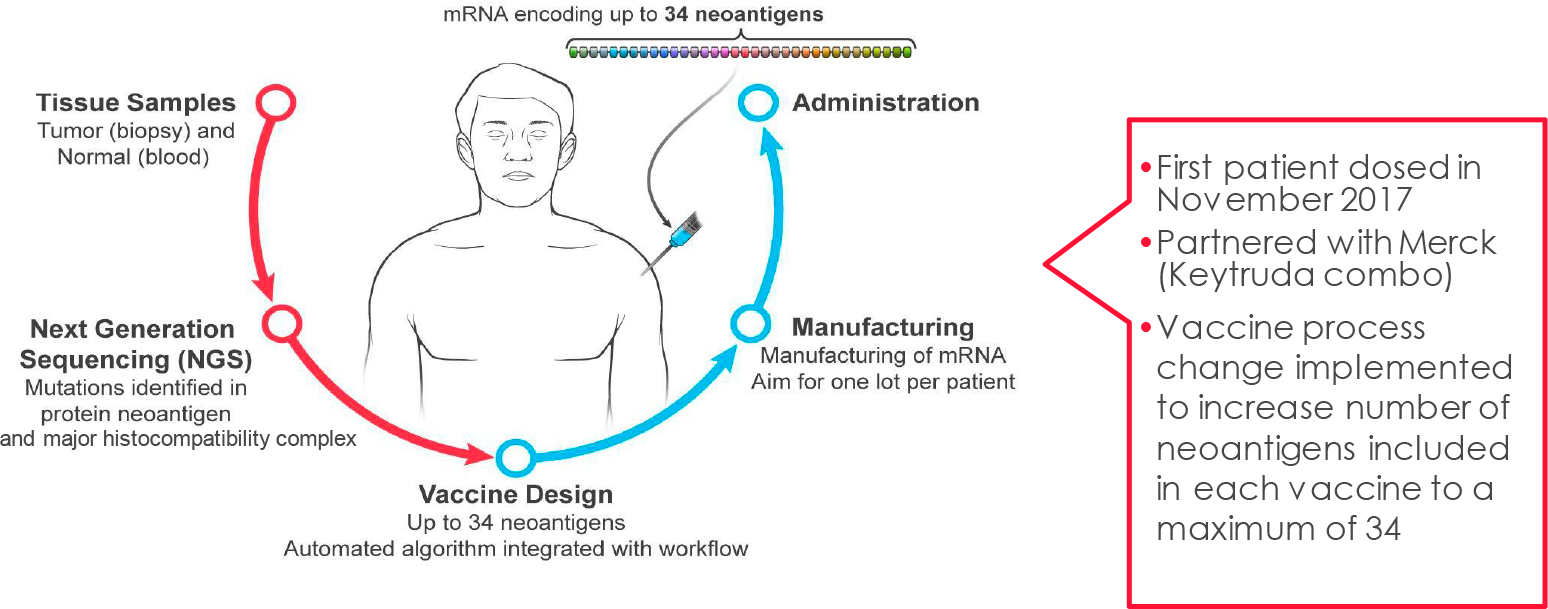
In silico собирается мРНК-последовательность, кодирующая одновременно до 34 эпитопов (неоантигенный конкатемер). Далее мРНК-молекулы инкапсулируются в фирменную оболочку из липидных наночастиц (LPN), которая наделяет готовый онковакцинный препарат толерантностью, минимизирует токсичность при многократном введении, помогает укрыться от надзора иммунной системы и защититься от ферментативного распада.
После внутримышечного введения персонализированной противораковой вакцины в организм антигенпрезентирующие клетки (APC) захватывают и транслируют мРНК-инструкции с дальнейшей экспрессией соответствующих эпитопов на своей поверхности. Итогом становится индуцирование специфических иммунных ответов со стороны цитотоксических T-клеток CD8+ и T-клеток памяти CD4+.
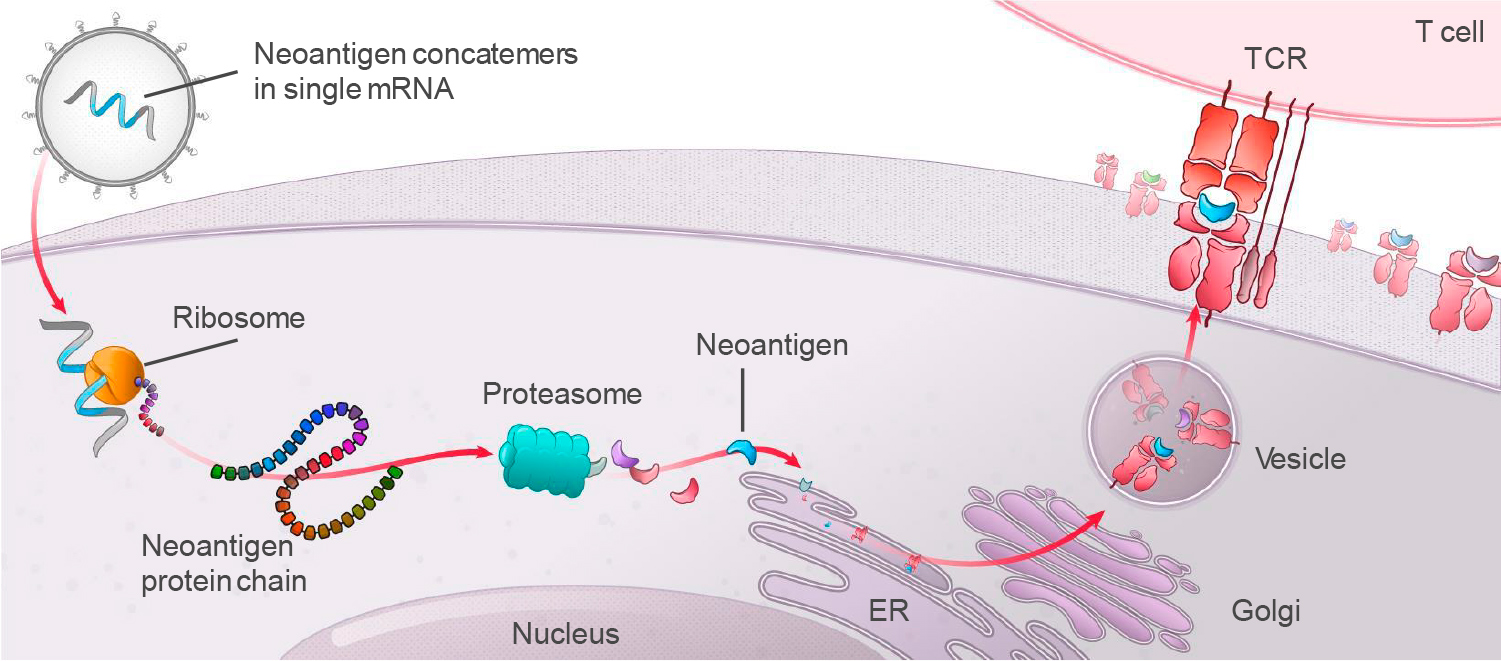
Доставка в организм сразу целого множества опухолеспецифических антигенов (TSA) должна резко повысить вероятность успешных клинических исходов, поскольку иммунная система начинает генерировать многовекторный T-клеточный ответ на неоантигенные пептиды, которые ей были презентированы. Другими словами, иммунная система проходит «обучение», по итогам которого усиливается ее способность распознавать и уничтожать опухолевые клетки.
В терминологии «Модерна» мРНК-вакцина mRNA-4157 (V940) относится к индивидуализированной неоантигенной терапии (Individualized Neoantigen Therapy, INT).
Разработка mRNA-4157 (V940) осуществляется совместно с «Мерк и Ко» (Merck & Co.), с которой «Модерна» в июне 2016 года вошла в стратегическое соглашение: первая выплатила второй 200 млн долларов авансом [1]. В мае 2018 года партнерство было расширено, что повлекло за собой финансовое вливание дополнительных 125 млн долларов [2]. В октябре 2022 года долгосрочный альянс укрепился еще сильнее: «Мерк и Ко» полностью поверила в успех mRNA-4157 (V940) [3].
КЛИНИЧЕСКАЯ ПРОВЕРКА
Продолжающееся клиническое исследование KEYNOTE-603 (NCT03313778) фазы I (нерандомизированное, открытое, многоцентровое) является основополагающим для дальнейшей разработки персонализированной противораковой вакцины mRNA-4157 (V940), поскольку изучает ее применимость различными схемами для лечения широкого ассортимента солидных опухолей.
Исследование охватывает такие диагнозы, как немелкоклеточный рак легкого (НМРЛ), мелкоклеточный рак легкого (МРЛ), меланома, уротелиальная карцинома (рак мочевого пузыря), плоскоклеточная карцинома головы и шеи (не индуцированная вирусом папилломы человека), протоковая аденокарциномы поджелудочной железы, а также любые злокачественные новообразования с высокочастотной микросателлитной нестабильностью (MSI-H) или дефектами в системе репарации ошибочно спаренных оснований ДНК (dMMR): например, колоректальный рак, аденокарцинома желудка и пищевода, рак эндометрия.
Параллельно осуществляется клиническое исследование KEYNOTE-942 (NCT03897881) фазы IIb (рандомизированное, открытое, многоцентровое, международное) среди пациентов с меланомой кожи (высокорисковой, на стадии IIIB–D или IV), которая метастазировала в лимфоузел и затем прошла полную хирургическую резекцию, но всё еще обладает высоким риском рецидива.
На момент рандомизации заболевание участников должно было быть в состоянии ремиссии, без локорегионарного рецидива, отдаленных метастазов, метастазирования в головной мозг.
Поставлена задача выяснить, оправдано ли добавление персонализированной мРНК-онковакцины mRNA-4157 (V940) к «Китруде» (Keytruda, пембролизумаб), блокатору PD-1 авторства «Мерк и Ко» (Merck & Co.), в целях продления безрецидивной выживаемости (RFS), если сравнивать с назначением только пембролизумаба (pembrolizumab). Предпосылки для этого очевидны: в адъювантных условиях (после резекции) опухоль отсутствует, пациент еще не проходил слишком много курсов химиотерапии, а его иммунная система относительно здорова.
Относительно недавно запущены следующие клинические испытания, оценивающие комбинацию mRNA-4157 (V940) и «Китруды» в задаче продления бессобытийной выживаемости после хирургической резекции, то есть удержания пациента в статусе ремиссии:
- INTerpath-001 (V940-001, NCT05933577) фазы III. Меланома кожи (на стадии IIB–C, III или IV) после хирургической резекции, без признаков заболевания, с высоким риском рецидива, ранее не проходившая системную терапию. mRNA-4157 (V940) + пембролизумаб — сравнение с пембролизумабом. Конечные точки: RFS, DMFS, OS.
- INTerpath-002 (V940-002, NCT06077760) фазы III. Немелкоклеточный рак легкого (НМРЛ) [на стадии II, IIIA или IIIB/N2] после хирургической резекции, без признаков заболевания, прошедший хотя бы одну линию адъювантной платиносодержащей химиотерапии. mRNA-4157 (V940) + пембролизумаб — сравнение с пембролизумабом. Конечные точки: DFS, OS, DMFS, LCSS.
- V940-004 (NCT06307431) фазы II. Почечно-клеточная карцинома (рак почки) после хирургической резекции, без признаков заболевания, с промежуточно-высоким или высоким риском рецидива, ранее не проходившая какой-либо лечение. mRNA-4157 (V940) + пембролизумаб — сравнение с пембролизумабом. Конечные точки: DFS, OS, DMFS.
- V940-005 (NCT06305767) фазы II. Мышечно-инвазивная уротелиальная карцинома (рак мочевого пузыря) после хирургической резекции, с высоким риском рецидива, ранее не проходившая системную терапию. mRNA-4157 (V940) + пембролизумаб — сравнение с пембролизумабом. Конечные точки: DFS, OS, DMFS.
- INTerpath-007 (V940-007, NCT06295809) фазы II/III. Плоскоклеточная карцинома кожи (на стадии II–IV без отдаленных метастазов), местнораспространенная, операбельная, ранее не проходившая какую-либо терапию. mRNA-4157 (V940) + пембролизумаб до и после хирургической резекции — сравнение с хирургической резекцией ± пембролизумаб. Конечные точки: EFS, ORR, FFS rate, pCR rate, mPR rate, DFS, DSS, OS.
Сокращения: DFS, выживаемость без признаков заболевания; DMFS, выживаемость без отдаленного метастазирования; DSS, выживаемость с учетом заболевания; EFS, бессобытийная выживаемость; FFS, свобода от хирургического вмешательства; LCSS, выживаемость, специфическая при раке легкого; mPR, большой патоморфологический ответ; ORR, частота общего ответа; OS, общая выживаемость; pCR, полный патоморфологический ответ; RFS, безрецидивная выживаемость.

Рак печени: персонализированная вакцина для полной ремиссии
Geneos Therapeutics придумала, как вылечить распространенную гепатоцеллюлярную карциному.
ЛЕЧЕНИЕ МЕЛАНОМЫ
По прошествии наблюдений на протяжении медианных 2 лет (23–24 месяца) за пациентами с меланомой из KEYNOTE-942 (NCT03897881) фазы IIb, которые получили либо mRNA-4157 (V940) с «Китрудой» (Keytruda, пембролизумаб), либо только пембролизумаб (pembrolizumab), экспериментальное комбинированное иммунотерапевтическое лечение клинически значимым (но не статистически!) образом улучшило безрецидивную выживаемость (RFS), снизив риск рецидива или смертельного исхода на 44%, если сравнивать с монотерапией пембролизумабом: отношение риска (hazard ratio, HR) 0,56 (95% ДИ [здесь и далее]: 0,31–1,02; двусторонний p=0,053) [1] [2] [3].
[membership level=»2,3″ show_noaccess=»true»]
В статусе RFS на протяжении 12 месяцев оказались 83% и 77% пациентов, 18 месяцев — 79% и 62% [4].

Непротиворечивое продление RFS, обеспеченное персонализированной мРНК-онковакциной с блокатором PD-1, было отмечено вне зависимости от уровня опухолевой мутационной нагрузки (TMB), балла опухолевого воспаления (TIS) и статуса PD-L1. Соответствующие показатели HR таковы [5]:
- высокая TMB (175 мутаций на экзом, или ≥ 10 мутаций на мегабазу) и невысокая TMB: 0,65 (0,28–1,49) и 0,59 (0,24–1,42);
- высокий TIS и невысокий TIS (отсечение 4,56): 0,58 (0,21–1,59) и 0,53 (0,25–1,10);
- опухоли, положительные (балл CPS ≥ 1) и отрицательные по PD-L1: 0,49 (0,23–1,04) и 0,16 (0,04–0,69).





По истечении 18 месяцев наблюдений с отдаленным метастазированием меланомы или смертельным исходом столкнулись 8% пациентов в группе комбинированного лечения и 24% — монотерапии «Китрудой». Частоты выживаемости без отдаленного метастазирования (DMFS) на протяжении 12 месяцев составили 93% и 89%, 18 месяцев — 92% и 77% [6] [7] [3].
Таким образом, добавление индивидуализированной противораковой вакцины mRNA-4157 (V940) к блокатору PD-1 пембролизумабу обеспечило клинически значимое улучшение показателя DMFS, снизив риск развития отдаленных метастазов или смерти на 65% в сравнении с лечением только «Китрудой» (HR 0,35 [0,15–0,83]; односторонний p=0,0063).

Установлено, что если до лечения не обнаруживалась циркулирующая опухолевая ДНК (ctDNA), которая отражает наличие минимально остаточной болезни (MRD) после опухолевой резекции и является биомаркером безрецидивной выживаемости при высокорисковой меланоме, прошедшей хирургическую операцию, то и ответ на терапию был лучше [8].
Так, среди пациентов с исходным негативным ctDNA-статусом показатели RFS и DMFS получились лучше при сравнении комбинированного лечения с монотерапией: риск рецидива или смерти и риск отдаленного метастазирования или смерти снизились на соответствующих 77% (HR 0,23 [0,10–0,53]) и 95% (HR 0,05 [0,01–0,38]). Впрочем, и при позитивном ctDNA-статусе были отмечены тенденции к улучшению RFS и DMFS, обеспеченные сочетанной терапией. Однако небольшая пациентская выборка не позволила сделать окончательные выводы, что эффективность терапевтической персонализированной противораковой вакцины mRNA-4157 (V940) в целом не зависит от изначального статуса ctDNA.


Индивидуализированная неоантигенная терапия mRNA-4157 (V940) работала лучше стандартного лечения вне зависимости от статуса BRAF: мутантный или дикого типа.

После медианных 3 лет наблюдений выяснилось, что лечение меланомы при помощи mRNA-4157 (V940) с пембролизумабом, клинически значимым образом улучшило показатели RFS и DMFS, снизив риск рецидива или смерти на 49% (HR 0,51 [0,29–0,91]; односторонний номинальный p=0,0095) и снизив риск развития отдаленных метастазов или смерти на 62% (HR 0,38 [0,17–0,86]; односторонний номинальный p=0,0077), если сравнивать с назначением только пембролизумаба [9].
[/membership]
СУТЬ
Длительное применение блокаторов PD-1 в адъювантном лечении резецированной высокорисковой меланомы в целях предупреждения ее возвращения — стандартная и эффективная клиническая практика [1] [2] [3], хотя и сопровождающаяся высоким риском хронической токсичности [4]. Однако терапевтическая персонализированная противораковая вакцина mRNA-4157 (V940) уже готова, кажется, обновить эту парадигму.
[membership level=»2,3″ show_noaccess=»true»]
Во всяком случае получены надежные доказательства улучшения RFS и DMFS в сравнении с нынешними терапевтическими подходами.
Так, наблюдения в течение 3,5 лет за пациентами, прошедшими годичный курс пембролизумаба (pembrolizumab), установили, что в статусах RFS и DMFS оставались 60% и 65% человек, а после 5 лет наблюдений — 55% и 61% [5] [6]. В случае годичной терапии ниволумабом (nivolumab) 4-летние показатели RFS и DMFS оказались справедливыми для 52% и 59% пациентов [7].
То есть в долгосрочной перспективе приблизительно половина пациентов сталкиваются с возвращением меланомы (или смертью), что вынуждает переходить к следующим линиям терапии. Таким образом, перед mRNA-4157 (V940) стояла задача как можно более продолжительного по времени сдерживания рецидива (RFS), который может усугубиться метастазированием (DMFS). И мРНК-онковакцина с таким упреждением справилась, хотя, впрочем, пока без подтвержденного статистически значимого расхождения с монотерапией пембролизумабом. Скорее всего, на это повлияла скромная по охвату выборка испытуемых.
Тем временем пембролизумаб засвидетельствовал оправданность своего одновременно назначения в неоадъювантном и адъювантном периодах, то есть равно как до резекции, так и после нее [8]. Сочетание ипилимумаба (ipilimumab) с ниволумабом продемонстрировало собственную пригодность в неоадъюватном периоде при определенных условиях [9] [10]. Гипотеза состоит в том, что еще не удаленная опухоль имеет достаточную массу, чтобы вызвать адекватную активацию и экспансию системного противоопухолевого T-клеточного ответа — такого же по силе, как в случае иммунотерапии рецидивирующей меланомы [11].
Открытым и важным остается вопрос с продлением общей выживаемости (OS): пока нет надежных данных, продлевают ли жизнь блокаторы PD-1, притом что конечные точки RFS и DMFS являются лишь суррогатными для OS, и делать какие-то определяющие заключения на их основе можно лишь с натяжкой [12].
В любом случае «Модерна» надо постараться с развитием mRNA-4157 (V940): в постковидную эпоху больше нет сверхдоходов от продажи вакцин против SARS-CoV-2.
С точки зрения бизнеса «Модерна» поступила чрезвычайно разумно, что потратила длительное время на проведение клинического испытания фазы IIb, прежде чем в конце июля 2023 года запустила решающую фазу III [13], поскольку было слишком много неудачных клинических исследований противораковых вакцин. Не всем нравится подобный промежуточный подход к разработке, но консервативная стратегия оправдана.

ВОЗ: дорогой ковид, до новых встреч!
Чрезвычайная ситуация, связанная с пандемией коронавирусной инфекции COVID-19, официально прекращена.
[/membership]
ЛЕЧЕНИЕ РАКА ГОЛОВЫ И ШЕИ
Промежуточный анализ клинических исходов KEYNOTE-603 (NCT03313778) фазы I в когорте лечения неоперабельной (метастатической или рецидивирующей) плоскоклеточной карциномы головы и шеи (HNSCC) [ротовой полости, ротоглотки, гортаноглотки, гортани], не индуцированной вирусом папилломы человека (HPV−), ранее не проходившей терапию какими-либо ингибиторами иммунных контрольных точек (ИИКТ), установил следующие результаты [1].
[membership level=»2,3″ show_noaccess=»true»]
На начало октября 2020 года, комбинация из индивидуализированной мРНК-онковакцины mRNA-4157 (V940) и PD-1-блокатора «Китруды» (Keytruda, пембролизумаб) обеспечила частоту общего ответа (ORR) на уровне 50% (n=5/10): полный ответ (CR) зафиксирован у 20% (n=2/10) пациентов, частичный ответ (PR) — у 30% (n=3/10). Стабилизация заболевания (SD) отмечена у 40% (n=4/10). С прогрессированием (PD) столкнулся один человек. Таким образом, частота контроля заболевания (DCR), как суммы CR, PR и SD, составила 90% (n=9/10).
Медиана длительности ответа (DoR) еще не созрела. Медиана выживаемости без прогрессирования (PFS) — 9,8 месяца.

Что примечательно, 4 из 5 респондентов ответили на лечение после двух доз пембролизумаба (pembrolizumab)— еще до назначения mRNA-4157 (V940). После того как они получили вакцину, ответы углубились: к примеру, два пациента с частичной ремиссией перешли к полной. Еще один человек, заболевание которого прогрессировало на фоне «Китруды», после вливания вакцины наконец-то засвидетельствовал частичный ответ.


Для сравнения: монотерапия пембролизумабом рецидивирующей или метастатической плоскоклеточной карциномы головы и шеи выводит ORR и медиану PFS к 14,6% и 2,0 месяца. Более того, экспериментальное вакцинное противораковое лечение превзошло стандартную первоочередную терапию, предполагающую назначение «Китруды» вместе с химиопрепаратами и выдающую ORR 36% и медиану PFS 4,9 месяца [2] [3] [4].
Любопытные выводы сделаны сообразно анализу предиктивных биомаркеров. Отмечена тенденция к благоприятному клиническому ответу у пациентов с опухолями, характеризующимися повышенным уровнем воспаления, о котором свидетельствуют баллы GEP (профиль генной экспрессии) и CYT (цитолитическая активность). При этом, однако, корреляции с опухолевой мутационной нагрузкой (TMB) не выявлено.
- Балл GEP, во-первых, отражает уровень РНК-экспрессии 18 воспалительных генов, имеющих отношение к антигенной презентации, экспрессии хемокинов, цитолитической активности и адаптивной иммунорезистентности (включая PD-L1), и, во-вторых, указывает на уровень T-клеточного воспаления в опухолевом микроокружении (TME). Балл CYT рассчитывается на основе транскрипционных уровней двух ключевых цитолитических эффекторов — гранзима A и перфорина.
Дальнейший анализ на начало мая 2023 года с медианой наблюдений в течение 9,0 (2,7–45,5) месяца и охвативший больше пациентов, установил следующие исходы: ORR 27% (11–50), включая CR 9% и PR 18%, DCR 64% (41–83), расчетные медианы PFS 3,5 (2,7–9,0) месяца и общей выживаемости (OS) 25,0 (9,0–NE) месяца [5].


[/membership]
СУТЬ
Пациенты с плоскоклеточной карциномой головы и шеи (HNSCC), отрицательной по вирусу папилломы человека (HPV−), характеризуются плохим прогнозом: пятилетняя частота выживаемости не превышает 50% [1].
[membership level=»2,3″ show_noaccess=»true»]
Считается, что ограниченный рост стойких клинических ответов на терапевтическую блокаду PD-(L)1 обусловлен снижением эффекторной цитолитической активности и клональным разнообразием [2] [3] [4] [5].
Поскольку индивидуализированная мРНК-онковакцина mRNA-4157 (V940), которая кодирует до 34 опухолевых неоантигенов, вызывает специфическую активацию противоопухолевых T-клеток, что было подтверждено успешным лечением меланомы, имело смысл опробовать ее назначение в связке с PD-1-блокатором пембролизумабом (pembrolizumab).
Иммуноонкологический коктейль продемонстрировал признаки активации иммунных реакций, которые обозначили себя среди ответивших на лечение в том числе снижением уровня циркулирующей опухолевой ДНК (ctDNA). «Более теплые» опухоли, такие как в случае HNSCC (HPV−), располагают более благоприятным опухолевым микроокружением (TME) для генерации T-клеточных ответов, индуцированных сочетанием mRNA-4157 (V940) c пембролизумабом. Кроме того, добавление неоантигенов, принесенных в составе персонализированной противораковой вакцины, снижает планку уровня опухолевой мутационной нагрузки (TMB), необходимого для должного терапевтического ответа на пембролизумаб.
Предварительные выводы таковы: при лечении HNSCC (HPV−) добавление мРНК-вакцины к стандартному пембролизумабу продлит общую выживаемость как минимум вдвое, если сравнивать с использованием только последнего.
[/membership]
ПРОТИВОРАКОВЫЕ ВАКЦИНЫ: ХОРОШО, ДА МАЛО
Несмотря на многообещающий потенциал противораковых вакцин, это направление биотехнологий развивается чрезвычайно медленно. Существует ряд препятствующих проблем: гетерогенность опухолевых антигенов и их мутационный разброс, отсутствие унифицированного сигнального пути распознавания антигенов с последующей активацией иммунного ответа, множество способов ухода раковых клеток от иммунологического надзора, выбор нужного иммуностимулирующего адъюванта, оптимальный путь доставки вакцины в организм.
Тем не менее на клиническом конвейере есть немало перспективных противораковых вакцин, включая персонализированные.
Ну а пока что в мире одобрены только две персонализированные противораковые вакцины: «Онкофаг» (Oncophage, витеспен) и «Провендж» (Provenge, сипьюлейсел-T).
Есть еще тройка противораковых препаратов на основе онколитических вирусов — «Онкорин» (Oncorine), «Имлайджик» (Imlygic, талимоген лагерпарепвек) и «Делитакт» (Delytact, тесерпатурев), применяемых в лечении соответственно карциномы головы и шеи, меланомы и злокачественной глиомы, — но к онковакцинам их можно отнести с натяжкой. Впрочем, механизм действия (хотя их несколько) этих лекарственных средств весьма близок: иммунной системе презентируются опухолевые антигены, накапливающиеся ввиду целенаправленного разрушения раковых клеток, индуцированного онколитическими вирусами.
Особняком стоит противотуберкулезная вакцина БЦЖ (бацилла Кальметта — Герена), которая почти полвека с большим успехом применяется в иммунотерапии рака мочевого пузыря без инвазии в мышечный слой (NMBIC).
ПЕРСОНАЛИЗИРОВАННЫЕ ПРОТИВОРАКОВЫЕ ВАКЦИНЫ: ИНДИВИДУАЛИЗИРОВАННОЕ ЛЕЧЕНИЕ ОНКОЛОГИИ
«ОНКОФАГ»
Персонализированная противораковая вакцина «Онкофаг» (Oncophage, витеспен) предназначена для адъювантной терапии прошедшей нефрэктомию локализованной почечно-клеточной карциномы (рака почки) с промежуточным риском рецидивирования.
[membership level=»2,3″ show_noaccess=»true»]
«Онкофаг», ранее известная как «Профаг» (Prophage), представляет собой комплекс, включающий белок теплового шока (HSP) gp96 и фрагментов пептидов, полученных из опухолевой ткани пациента. Аутологичный антигенный комплекс витеспен (vitespen, HSPPC-96) стимулирует резидентные дендритные клетки, которые активируют цитотоксические T-лимфоциты (CTL) и T-хелперы — ключевые компоненты каскада противоопухолевого иммунного ответа [1].

«Онкофаг» разработана «Антидженикс» (Antigenics), которая в январе 2011 года сменила название на «Адженус» (Agenus) [2].
«Онкофаг» получила регуляторное разрешение только в России, где была одобрена в апреле 2008 года [3] [4].
В ноябре 2009 года «Антидженикс» отозвала заявку на регистрацию «Онкофага» в Европейском союзе, после того как экспертный комитет при Европейском агентстве по лекарственным средствам (EMA) пришел к заключению, что онковакцина не в силах существенно продлить безрецидивную выживаемость. Кроме того, производитель не предоставил полной информации относительно состава «Онкофага» и его производственного процесса, а также механизма действия при почечно-клеточной карциноме и выбора нужной дозы [5].
Применение «Онкофага» снижает риск прогрессирования заболевания или смерти (PFS) на 41% (HR 0,59 [0,37–0,94]; p=0,026) и риск смерти (OS) на 46% (HR 0,54 [0,30–0,97]; p=0,036) [6] [7].
[/membership]
«ПРОВЕНДЖ»
Персонализированная противораковая вакцина «Провендж» (Provenge, сипулейцел-T) предназначена для лечения бессимптомного или минимально симптоматического метастатического кастрационно-резистентного рака предстательной железы.
[membership level=»2,3″ show_noaccess=»true»]
«Провендж» производится из собственных мононуклеарных клеток периферической крови (PBMC) пациента, включая антигенпрезентирующие клетки (APC), T- и B-лимфоциты, естественные киллеры (NK), которые затем активируются ex vivo рекомбинантным человеческим белком PAP-GM-CSF. Последний представляет собой композицию из простатической кислой фосфатазы (PAP) — антигена, высокоэкспрессирующего в опухолевых тканях при раке простаты, и гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) — активатора иммунных клеток. После внутривенного вливания сипулейцела-T (sipuleucel-T, APC-8015) запускаются процессы гуморального и T-клеточного иммунного противоопухолевого ответа [1] [2].

«Провендж» разработана «Дендрион» (Dendreon), которую в феврале 2015 года за 495 млн долларов купила канадская «Валеант фармасьютикалс интернешнл» (Valeant Pharmaceuticals International), уже в июле 2017-го продавшая ее за 820 млн долларов китайскому конгломерату Sanpower Group [3] [4] [5] [6]. Через год последняя перепродала «Дендрион» за 868 млн долларов китайской Nanjing Cenbest, крупному розничному ретейлеру, решившему заняться биотехнологическим бизнесом. Впрочем, сделка по сути номинальная, ведь Sanpower является крупнейшим акционером Nanjing Cenbest [7].
В апреле 2010 года «Провендж» была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) [8].
В сентябре 2013 года «Провендж» получила маркетинговое разрешение Европейского агентства по лекарственным средствам (EMA), однако в мае 2015-го регистрация была прекращена по просьбе «Дендрион» ввиду коммерческих соображений [9].
Терапевтическая эффективность «Провендж» весьма скромная: персонализированная противораковая вакцина, снижая риск смерти на 22% (HR 0,78 [0,61–0,98]; p=0,032), продлевает жизнь на медианных 4,1 месяца относительно плацебо [10]. И это притом что за курс лечения из 3 доз необходимо выложить почти 200 тыс. долларов при отсутствии страхового медицинского покрытия [11].
[/membership]