«Кто имеет уши слышать, да слышит» (Мф. 13:9).
«ОЛИГОМАННАТ»: КИТАЙСКОЕ ФАРМЧУДО
В начале ноября 2019 года в Китае был одобрен «Олигоманнат» (Oligomannate, олигоманнат натрия) — новый лекарственный препарат, предназначенный для терапии легко-умеренной болезни Альцгеймера [1].
Критическая важность олигоманната натрия (sodium oligomannate, GV-971), разработанной местной «Шанхай Грин Валли фармасьютикалс» (Shanghai Green Valley Pharmaceuticals) и в Китае проходящей под брендовым названием «Цзюции» (Jiuqiyi, 九期一), состоит в том, что лекарственное средство стало первым за полтора десятка лет, которому удалось засвидетельствовать улучшение когнитивных функций у пациентов с этим разрушительным нейродегенеративным заболеванием.
В конце декабря 2019 года «Олигоманнат» поступил на рынок Китая по цене 895 юаней за упаковку (129 долларов) из 42 капсул, или 3580 юаней (516 долларов) за месячный курс лечения из четырех упаковок [2] [3]. Стоимость была выставлена приблизительно вдвое дороже ингибиторов ацетилхолинэстеразы.
С конца 2021 года «Олигоманнат» включен в Национальный список возмещения расходов на приобретение лекарственных препаратов (National Reimbursement Drug List, NRDL). Но для этого «Грин Валли» пришлось сделать серьезную скидку, опустив ценник на 67% — до 296 юаней (43 доллара) за упаковку, или 1184 юаней (172 доллара) за месячный курс. Поскольку приобретение препарата китайскими пациентами субсидируется государством приблизительно наполовину и покрывается страховкой, ежемесячные расходы из собственного кармана больного или его семьи на лечение «Олигоманнатом» не превышают 600 юаней (86 долларов) [4] [5] [6].
Нынешний фармакологический арсенал для борьбы с болезнью Альцгеймера располагает скудным ассортиментом медикаментов, и они ориентированы лишь на поддерживающую терапию деменции. Ингибиторы ацетилхолинэстеразы, такие как такрин (tacrine), ривастигмин (rivastigmine), галантамин (galantamine) и донепезил (donepezil), а также антагонист NMDA-рецептора мемантин (memantine) — все они характеризуются весьма слабой симптоматической эффективностью. Никакой из официально разрешенных препаратов не останавливает и не обращает вспять неминуемое прогрессирование болезни Альцгеймера.
Многие фармкомпании, включая большинство игроков «Большой фармы», располагающих практически неограниченными ресурсами, пробовали победить деменцию. Бесчисленные экспериментальные молекулы провалились, в трубу вылетели сотни миллиардов долларов, а надежды пациентов так и остались тщетными.
Даже такая мощная терапевтическая модальность, как моноклональные антитела, включая адуканумаб (aducanumab), леканемаб (lecanemab) и донанемаб (donanemab), одобренные в терапии болезни Альцгеймера, лишь сдерживают прогрессирование деменции в скромных пределах 20–27% относительно плацебо.
Улучшить когнитивные функции при болезни Альцгеймера удалось разве что мазитинибу (masitinib), бунтанетапу (buntanetap) и симуфиламу (simufilam). Но вопросов и претензий к этим всё еще экспериментальным лекарственным соединениям остается много — даром что ли регуляторы вовсе не торопятся их одобрять, несмотря на высочайшую незакрытую медицинскую потребность.
«ОЛИГОМАННАТ»: КЛИНИЧЕСКАЯ РЕЗУЛЬТАТИВНОСТЬ
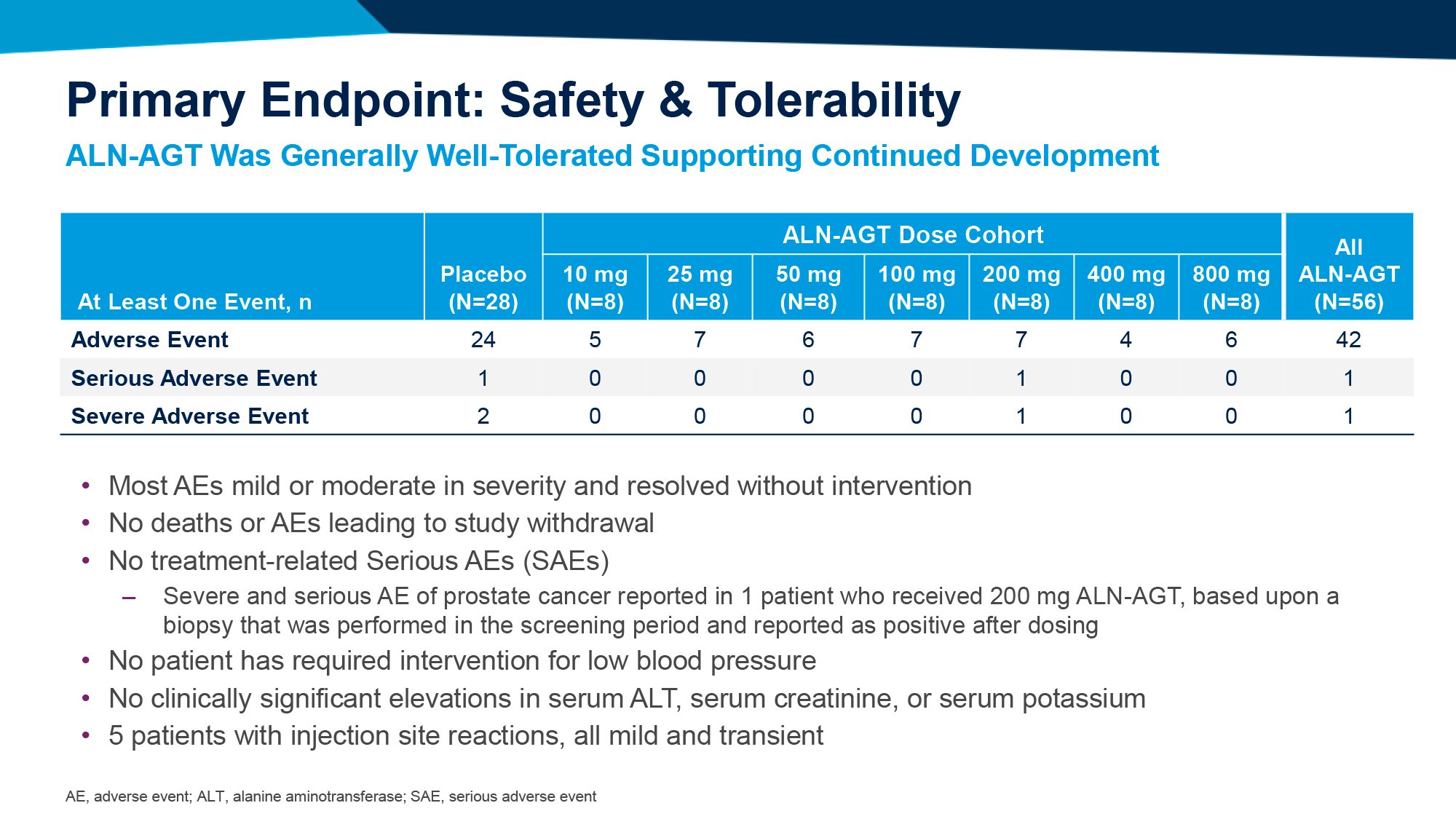
Регуляторное одобрение «Олигоманната» (Oligomannate, олигоманнат натрия) исходило из результатов клинического исследования NCT02293915 фазы III (рандомизированного, двойного слепого, плацебо-контролируемого, многоцентрового), которое проверило эффективность и безопасность олигоманната натрия (sodium oligomannate, GV-971) среди китайских пациентов (n=818) в возрасте 50–85 лет с болезнью Альцгеймера, характеризующейся легкой или умеренной тяжестью (общий балл по краткой шкале оценки психического статуса [MMSE] в диапазоне от 11 до 26).
Среди подтвержденных на МРТ головного мозга критериев включения в испытание: атрофия медиальной височной доли ≥ 2 по визуальной оценочной шкале; степень поражения белого вещества < 3 по шкале Фазекаса; не более двух очагов лакунарного инфаркта и их отсутствие в жизненно важных областях, таких как таламус, гиппокамп, энторинальная кора, околообонятельная область, кора и другие подкорковые ядра серого вещества.
На протяжении 36 недель участники получали пероральный «Олигоманнат» в дозе 450 мг или плацебо — два раза в день. Первичная конечная точка эффективности лечения была установлена изменением когнитивных функций в ходе выполнения 12 задач в рамках шкалы оценки тяжести болезни Альцгеймера (ADAS-Cog12).
Группа олигоманната натрия продемонстрировала статистически значимое улучшение когнитивных функций по сравнению с группой плацебо: балл ADAS-Cog12 снизился [меньше — лучше] на усредненных 2,70 пункта — против его снижения на 0,16 пункта в контрольной группе; нескорректированная разница изменения составила −2,54 пункта [1].
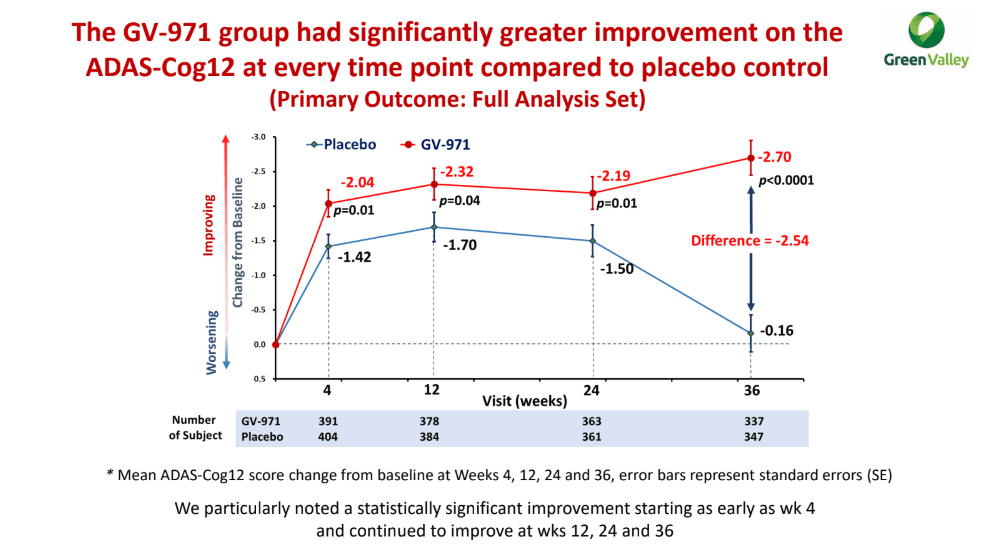
Расхождение наблюдалось, начиная уже с 4-й недели терапии, устойчиво сохраняясь до конца испытания. Улучшения не зависели ни от исходного балла когнитивных способностей, ни от наличия или отсутствия аллеля ε4 аполипопротеина E (APOE) — известного генетического фактора риска развития болезни Альцгеймера.
Отмечена статистически незначимая тенденция к улучшению по шкале оценки состояния пациента на основании впечатления врача и ухаживающих за пациентами лиц (CIBIC+) [p=0,059]. Не выявлено статистически значимых улучшений по таким критериям, как шкала повседневной активности при болезни Альцгеймера (ADCS-ADL) [p=0,57], нейропсихиатрический опросник (NPI) [p=0,80], метаболизм глюкозы в билатеральной височно-теменной коре (CMRglu) согласно позитронно-эмиссионной томографии с использованием фтордезоксиглюкозы (FDG-PET).
Профиль безопасности олигоманната натрия не отличался от такового в контрольной группе. Случаев вазогенного отека головного мозга (ARIA-E), расхожих при таргетировании на бета-амилоид, не зафиксировано [2].
В ходе дальнейшего уточнения результатов клинической проверки «Олигоманната» выяснилось следующее [3].
Средняя смоделированная разница между группами лечения (группа препарата минус группа плацебо) в отношении изменений от исходного уровня до 36-й недели лечения составила −2,15 пункта (95% ДИ [здесь и далее]: −3,07, −1,23; p<0,0001; размер эффекта Коэна d 0,53).
Назначение олигоманната натрия отметилось целительным эффектом вне зависимости от тяжести болезни Альцгеймера. Так, скорректированная разница балла по шкале ADAS-Cog12 в подгруппах пациентов с баллом MMSE, равным 11–14, 15–19 или 20–26 (чем больше балл MMSE, тем менее нарушены когнитивные способности), составила −4,20 пункта (−6,28, −2,12), −3,00 пункта (−4,57,−1,43) и −1,59 пункта (−2,35, −0,83) [p<0,0001, p=0,0003 и p<0,0001].
Лечение болезни Альцгеймера «Олигоманнатом» засвидетельствовало непротиворечивый терапевтический эффект улучшения балла ADAS-Cog12 сообразно разбивке пациентов на следующие подгруппы:
- наличие APOE-ε4: −2,40 ( −3,37, −1,43);
- отсутствие APOE-ε4: −2,67(−3,74, −1,60);
- возраст ≤ 65 лет: −2,55 (−3,73, −1,37);
- возраст > 65 лет: −2,48 (−3,36, −1,60);
- мужской пол: −2,94 (−3,96, −1,92);
- женский пол: −2,13 (−3,11, −1,15);
- образование выше среднего: −2,37 (−3,12, −1,62);
- среднее образование: −3,29 (−5,18, −1,40).
Несмотря на то, что изменения вторичных конечных точек, таких как CIBIC+, ADCS-ADL и NPI, не оказались статистически значимыми, наблюдалась корреллирующая со степенью тяжести болезни Альцгеймера тенденция в пользу улучшения этих показателей. При этом в подгруппе пациентов с баллом MMSE 11–14 была установлена статистически значимая разница с контрольной группой по показателю NPI: размер эффекта 1,3 (p=0,017).
Применение олигоманната натрия характеризовалось приемлемой переносимостью. Не выявлено какого-либо серьезного расхождения с группой плацебо в отношении нежелательных явлений (НЯ), их тяжести и частоты. Разве что в группе препарата чуть более частыми были такие НЯ, как гиперлипидемия и назофарингит.







Как полагают исследователи, CIBIC+, ADCS-ADL и NPI, соответственно отражающие глобальную когнитивную функцию, способность к ежедневной деятельности и поведенческие симптомы, могли не улучшиться в ходе лечения по ряду причин. Во-первых, ограниченный размер выборки пациентов в клиническом испытании. Во-вторых, относительно короткая длительность самого исследования. В-третьих, культурные различия между западным и восточноазиатским мирами могли исказить чувствительность и достоверность оценки прогрессирования заболевания и фармакологические эффекты от лечения, поскольку указанные шкалы слишком универсальны, чтобы безоговорочно распространять их на всю человеческую популяцию.
Опять же, необычайно сильный ответ в группе плацебо связан, возможно, с высокой пропорцией пациентов с легкой формой болезни Альцгеймера, а также превосходным уходом за больными в ходе этого клинического испытания и высокими ожиданиями от лечения со стороны участников и лиц, за ними ухаживающих. Похожие сильные эффекты плацебо наблюдались и в ходе других исследований, проведенных в Китае, что связано, как уже упоминалось, с существенными культурными различиями [4] [5] [6] [7].
Так, в экономически развитых странах Запада пожилые люди обычно проживают отдельно от родственников, и потому даже незначительные ухудшения когнитивных способностей отражаются серьезными нарушениями самостоятельной ежедневной активности. В Китае, Японии, Корее и на Тайване, напротив, пожилые почти всегда получают более чем сильную поддержку со стороны своих родственников, поэтому оценка их когнитивных способностей зачастую является размытой.
«ОЛИГОМАННАТ»: КОМУ ОН ПОМОЖЕТ
Исходя из имеющихся клинических данных, можно смело утверждать, что терапевтический эффект «Олигоманната» (Oligomannate, олигоманнат натрия) превышает таковой для одобренных препаратов, включая пресловутый донепезил.
Следует понимать, что снижение когнитивных функций при болезни Альцгеймера оценочно распределено на семь стадий: от первой «нормальной» (без каких-либо когнитивных нарушений) до седьмой «очень тяжелой» (с тяжелой деменцией) [1]. «Олигоманнат» был клинически изучен среди пациентов с заболеванием до четвертой стадии (с легкой деменцией) включительно, которая проявляется трудностями с осуществлением простых арифметических операций, плохой кратковременной памятью (например, невозможно вспомнить, что было съедено на завтрак), неспособностью управлять собственными финансами и оплачивать счета, забыванием подробностей из жизни.










Постояльцы с деменцией в реабилитационном центре Цыхуэй в Гуанчжоуском доме престарелых (Cihui Rehabilitation Center for the Aged, Гуанчжоу, пр. Гуандун, Китай). Изображения: China Photos / Getty Images.Если болезнь Альцгеймера прогрессировала дальше, олигоманнату натрия (sodium oligomannate, GV-971) вряд ли по силам «исправить» запущенную до такой степени нейродегенерацию головного мозга, когда пациент уже столкнулся с неспособностью самостоятельно обслуживать себя в быту.
«Олигоманнат» не рекомендован в качестве профилактического препарата для пожилых пациентов без каких-либо признаков и симптомов болезни Альцгеймера, поскольку неизвестно, оказывает ли он превентивный эффект.
Особняком стоит высказанная сторонним исследователем гипотеза, будто бы олигоманнат натрия обладает противовирусным действием, которое важно в условиях болезни Альцгеймера. Накоплено немало свидетельств, что вирус простого герпеса первого типа (ВПГ-1) играет важную роль в развитии этого заболевания. Судя по данным множества исследований, ВПГ-1, находящийся в латентном состоянии в головном мозге, периодически реактивируется, а вызываемые им повреждения постепенно накапливаются, в конечном итоге приводя к развитию деменции. Известно, что противовирусная и вирулицидная активность полисахаридов морского происхождения связана со специфической структурой сахара, молекулярной массой и степенью сульфатирования. Если получится подтвердить, что олигоманнат натрия располагает таковыми эффектами, его уместно добавлять к противовирусным препаратам вроде ацикловира или валацикловира в целях снижения риска развития болезни Альцгеймера на фоне рецидива инфекции ВПГ-1 [2].
«ОЛИГОМАННАТ»: КАК ОН РАБОТАЕТ
Несмотря на масштабные усилия мировой фармацевтической отрасли, проверившей свыше трех сотен лекарственных соединений в попытках отыскать эффективную терапию болезни Альцгеймера, все попытки завершались неудачами, разочаровывающими пациентов, врачей, инвесторов. Величайшая загадка, что же лежит в основе развития этого смертоносного нейродегенеративного заболевания, определила провал 99,6% всех экспериментальных лекарств [1]. В подавляющем большинстве случаев фармкомпании пробовали доказать состоятельность амилоидной гипотезы, полагающей, что устранение из головного мозга нейротоксичных внеклеточных отложений бета-амилоида даст должный лечебный эффект. Многие десятки миллиардов долларов растворились в «черной дыре» борьбы со старческим слабоумием.
Китайская «Шанхай Грин Валли фармасьютикалс» (Shanghai Green Valley Pharmaceuticals) сделала ставку на решительно иную теорию, обращающуюся к гипотезе «кишечник — мозг» [2].
Исследования на животных и людях указали на наличие динамического взаимодействия между микробиотой (совокупность сообществ комменсальных, симбиотических и патогенных микроорганизмов) кишечника и адаптивной иммунной системой организма [3] [4]. Дисбиоз (дисбактериоз) кишечной микробиоты (микрофлоры), то есть нарушение баланса, ставит под угрозу иммунные реакции хозяина и способствует развитию различных воспалительных состояний [5].
В случае болезни Альцгеймера обнаружены свидетельства, что нарушения в разнообразии микроорганизмов, населяющих кишечник, приводят к опосредованному микроглиальной активацией нейровоспалению и амилоидозу [6] [7] [8] [9] [10] [11] [12]. Связь между кишечным микробиомом (непосредственно микробиота плюс геномы микроорганизмов, их продукты жизнедеятельности и способы взаимодействия между собой и с организмом-хозяина) и микроглией, как предполагается, опосредована передачей сигнала через либо блуждающий нерв, либо цитокины и метаболиты, выделяемые микробиотой в периферическую циркуляцию [13].
Известно также, что инфильтрирующие периферические иммунные клетки, такие как T-клетки CD4+ и CD8+, участвуют в нейровоспалении в условиях болезни Альцгеймера. Так, в мышиных моделях периферические T-хелперы 1-го и 17-го типов (Th1 и Th17) были ассоциированы с высвобождением воспалительных цитокинов. Периферически инфильтрированные лимфоциты обнаруживались в головном мозге как трансгенных мышей, так и непосредственно пациентов с болезнью Альцгеймера [14] [15] [16].
Специалисты «Грин Валли» предположили, что, поскольку углеводы (в форме моно- или олигосахаридов) являются основным источником питательных веществ для бактерий, то вполне можно модулировать микробиоту, сдвигая популяцию микроорганизмов в нужную сторону — путем доставки в организм особых, терапевтически подходящих углеводных соединений, по сути выступающих пребиотиками. И в случае болезни Альцгеймера речь идет о пероральном олигоманнате натрия (sodium oligomannate), также известном как олигоманнурарат натрия (sodium оligomannurarate) и GV-971, который представляет собой смесь кислых линейных олигосахаридов (со степенями полимеризации от димеров до декамеров и молекулярной массой в диапазоне 670–880 Да), полученных из морских бурых водорослей Ecklonia kurome.

Вообще же оригинальная идея отталкивалась от наблюдений, что пожилые люди, регулярно употребляющие в пищу морские водоросли, относительно редко сталкиваются с болезнью Альцгеймера.
На мышиных моделях с бета-амилоидным амилоидозом весьма элегантно было показано, как именно дисбиоз кишечной микробиоты, приводящий к изменению метаболизма аминокислот и периферического адаптивного иммунитета, способствует прогрессированию болезни Альцгеймера. Повышенные уровни фенилаланина и изолейцина увеличивают разнообразие плазматических Th1, которые, пролиферируя, дифференцируясь и инфильтрируя в паренхиму головного мозга, промотируют нейровоспаление (за счет роста количества провоспалительной цитотоксической микроглии фенотипа M1) и вносят непосредственный вклад в патогенез болезни Альцгеймера, проявляющийся отложениями бета-амилоида и нейрофибриллярных клубков. Назначение олигоманната натрия восстанавливало микробиоту кишечника и ограничивало вклад модифицированного периферического иммунитета в патогенез [17].


Позже было продемонстрировано, что олигоманнат натрия прямо или косвенно активирует рецепторы сладкого вкуса и ионный канал TRPA1, тем самым усиливая вход кальция в энтероэндокринные клетки, что приводит к увеличению выброса серотонина и кишечного нейропептидного гормона холецистокинина с последующим результирующим усилением афферентной активности блуждающего нерва. Это, возможно, отражается модуляцией когнитивных функций [18].
Последующая проверка на APP/PS1, мышиной модели болезни Альцгеймера, установила, что трехмесячное назначение олигоманната натрия привело к улучшению когнитивных функций, подавило нейровоспаление за счет снижения экспрессии бета-секретазы 1 (BACE1), уменьшило отложения токсичного бета-амилоида [19] [20].
Некоторое количество олигоманната натрия в своей первоначальной форме также проникает через гематоэнцефалический барьер [21] посредством транспортеров, включая транспортер глюкозы 1 типа (GLUT1) [22]. Далее олигоманнат натрия напрямую связывается со множеством субрегионов бета-амилоида, ингибируя образование бета-амилоидных фибрилл [23] и дестабилизируя уже сформированные фибриллы в нетоксичные мономеры [24]. In vitro олигоманнат натрия, воздействуя на бета-амилоид, способствует его фагоцитозу микроглией.
Позже было высказано предположение, что олигоманнат натрия связывается с бета-амилоидом благодаря мультисайтовым электростатическим взаимодействиям между карбоксильными группами первого и тремя гистидиновыми остатками второго, и это препятствует нежелательной нейротоксичной агрегации последнего [25].
В организме человека олигоманнат натрия, устраняя дисбиоз микробиоты кишечника, подавляет, есть мнение, аномально высокую активность метаболитов последней, модулирует периферическое и центральное воспаление, уменьшает отложения бета-амилоида и гиперфосфорилирование тау-белка, обращает вспять когнитивные нарушения. Впрочем, точный механизм действия препарата остается невыясненным — несмотря на тот факт, что во всех его клинических испытаниях приняли участие приблизительно 2 тыс. человек с болезнью Альцгеймера.
Если придерживаться комплексной картины перорального применения полисахаридов естественного происхождения в борьбе с болезнью Альцгеймера, накоплено немало научных данных их пригодности для реализации этой задачи. Целый ряд полисахаридов, согласно экспериментам in vitro и in vivo, способен облегчать патологические повреждения и улучшать когнитивные симптомы за счет противодействия нейротоксичности бета-амилоида и тау-белка, ослабления окислительного стресса и провоспаления, восстановления нейропластичности [26].
«ОЛИГОМАННАТ»: ДОПОЛНИТЕЛЬНЫЕ НАУЧНЫЕ СВИДЕТЕЛЬСТВА
Специалисты из Университета Вашингтона в Сент-Луисе и Чикагского университета независимо друг от друга изучили роль олигоманната натрия (sodium oligomannate, GV-971) в лечении болезни Альцгеймера на APPPS1-21 и 5XFAD, мышиных моделях бета-амилоидного амилоидоза и нейровоспаления [1].
Было установлено, что эта смесь олигосахаридов морского происхождения значительно ослабила церебральный амилоидоз, существенно повлияла на метаболизм микробиома, явно изменила метагеномику и метаболомику с заметным снижением периферических и центральных профилей провоспалительных цитокинов и хемокинов, а также сдержала активацию астроцитов и уменьшила количество реактивной микроглии, ассоциированной с бета-амилоидными бляшками. Была подтверждена роль триптофана, дисбаланс метаболизма которого и последующих путей ассоциирован, как известно, с многочисленными нейродегенеративными и нервно-психическими заболеваниями: олигоманнат натрия повысил метаболизм триптофана и других аминокислот.
Что примечательно, наиболее выраженные эффекты олигоманнат натрия оказал на самцов трансгенных мышей. Половая специфика точного объяснения пока не нашла, но, вероятно, включает влияние гормонов яичников, различия в профилях кишечной микробиоты и различия в транскрипционных исходах в микроглии.
В своей последней публикации Гэн Мэйюй (Geng Meiyu, 耿美玉), ведущий разработчик олигоманната натрия, попыталась закрыть пробел в понимании молекулярной связи между кишечными бактериями, прогрессированием болезни Альцгеймера и механизмом действия препарата [2].
Был выявлен штамм Lactobacillus murinus (L.m.) с высокой экспрессией гена, который кодирует адгезин, содержащий Rib-повторы (Ribhigh—L.m.), и который особенно выражен у трансгенных мышей 5XFAD. Механистически адгезия Ribhigh—L.m. к эпителию кишечника повышала уровень фекальных метаболитов, среди которых первое место занимал лактат. Избыток лактата стимулировал выработку эпителием сывороточного амилоида А (SAA) в кишечнике через ось GPR81–NFκB, способствуя периферической активации Th1. Олигоманнат натрия нарушал адгезию Ribhigh—L.m. к эпителию кишечника через прямое связывание с Rib, что привело к коррекции избытка лактата, снижению уровня SAA и ослаблению Th1-воспаления.

«ОЛИГОМАННАТ»: БЛИЖАЙШЕЕ БУДУЩЕЕ
«Олигоманнат» (Oligomannate, олигоманнат натрия) получил условное разрешение: с недавних пор китайскому регулятору дозволено выносить благоприятный вердикт в отношении всё еще находящихся в процессе изучения препаратов, если они характеризуются «предсказуемой» клинической ценностью в случае жизнеугрожающих заболеваний, для которых нет эффективного лечения либо таковое предлагается глобальными фармацевтическими компаниями, но по недоступным для большинства населения ценам.
В случае олигоманната натрия (sodium oligomannate, GV-971) условность регуляторного вердикта вызвана тем, что «Шанхай Грин Валли фармасьютикалс» (Shanghai Green Valley Pharmaceuticals) не успела подготовить отчет по долгосрочной безопасности на грызунах [1].
Теперь же для полноценного одобрения олигоманнату натрия предстоит безоговорочно и безусловно подтвердить собственные долгосрочные безопасность и эффективность — путем проведения постмаркетинговых клинических испытаний [2].

«Грин Валли» продолжает осуществлять три клинических исследования фазы IV олигоманната натрия при легко-умеренной болезни Альцгеймера: два из них, NCT05058040 (CTR20210760) и NCT05181475 (CTR20212999), в открытую проверяют долгосрочные 96-недельные соответственно безопасность (n=2500) и эффективность (n=800), а третье, NCT05908695 (CTR20231675), будучи плацебо-контролируемым, изучает эффективность и изменения биомаркеров на протяжении 36 недель лечения (n=1312). Готовность результатов первых двух испытаний ожидается к середине 2025 года.
Особняком стоят клинические исследования, 36-недельное NCT05114499 и 48-недельное NCT05430867, спонсируемые Первой клинической больницей Сианьского университета Цзяотун (Xi’an Jiaotong University, XJTU, 西安交通大学, Сиань, пр. Шэньси, Китай): они тестируют сочетание олигоманната натрия с соответственно донепезилом (при легко-умеренной болезни Альцгеймера; n=150) и мемантином (при умеренно-тяжелой; n=150). Результаты будут собраны, как предполагается, к концу 2024 года.
Небольшое когортное исследование среди пациентов (n=60) с легко-умеренной деменцией по причине болезни Альцгеймера подтвердило терапевтическую оправданность добавления олигоманната натрия к донепезилу: комбинированное лечение улучшило клинические исходы по сравнению с применением только последнего, если говорить о когнитивных функциях и повседневной активности [3] [4].
«ОЛИГОМАННАТ»: ОСТАЛЬНОЙ МИР ПОДОЖДЕТ
«Шанхай Грин Валли фармасьютикалс» (Shanghai Green Valley Pharmaceuticals) намеревалась предложить «Олигоманнат» (Oligomannate, олигоманнат натрия) нуждающимся пациентам во всём мире, и потому на начало 2020 года планировала запуск регистрационного международного клинического испытания GREEN MEMORY (NCT04520412, CTR20210187) фазы III с привлечением людей с болезнью Альцгеймера, проживающих на территории США, Европы и Азии. Попутно в ходе исследования должны были быть собраны данные по определенным биомаркерам этого нейродегенеративного заболевания, которые помогли бы прояснить механизм действия препарата в человеческом организме. Тогда, к слову, открылась бы возможность для рационального дизайна обновленной версии лекарства с усиленным таргетным воздействием.
Намечалось, что клиническое исследование (рандомизированное, двойное слепое, многоцентровое, международное) охватит 2046 пациентов (в возрасте 50–85 лет) с легко-умеренной болезнью Альцгеймера (MMSE 11–24) и будет проводиться в 200 клинических центрах 14 стран Северной Америки, Европейского союза, Восточной Европы, Азиатско-Тихоокеанского региона: на долю США и Европы должно было прийтись по 30% пациентов, тогда как оставшиеся 40% были бы приглашены в Китае. Испытания длительностью 18 месяцев должны были завершиться в 2024 году. Отправка регистрационного досье в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) и Европейское агентство по лекарственным средствам (EMA) была бы произведена буквально незамедлительно. Десятилетние инвестиции в проект «Олигоманната» оценивались в 3 млрд долларов: в затраты входили равно как клиническая проверка и выяснение точного механизма действия препарата, так и его изучение в терапии других заболеваний, включая болезнь Паркинсона и сосудистую деменцию [1] [2].
В начале апреля 2020 года FDA выдало «Грин Валли» разрешение на проведение GREEN MEMORY, состоящего из 52-недельного двойного слепого периода и последующего 26-недельного открытого. Если бы исследование, как намечалось, завершилось в 2024 году, то заявка на регистрацию олигоманната натрия (sodium oligomannate, GV-971) была бы подана к 2025-му [3].
Если бы «Грин Валли» научно доказала, что «Олигоманнат» действительно работает, для нее открылись бы шикарнейшие бизнес-перспективы объемом не менее чем 30 млрд долларов в одних только США. Сейчас не менее чем 55 млн человек в мире страдают деменцией, притом что в 60–80% ее случаев причиной является как раз болезнь Альцгеймера. В 2019 году мировые расходы, связанные с уходом за больными деменцией, оценивались в 1,3 трлн долларов, причем половина этого финансового бремени приходилась на лиц, осуществляющих неоплачиваемый уход. К 2030 и 2050 гг. заболевание, как прогнозируется, охватит соответственно 78 млн и 139 млн человек ввиду того, что продолжительность жизни увеличивается, а население планеты стареет [4] [5] [6] [7].
«Грин Валли» даже собиралась возвести новую производственную площадку в Шанхае, удовлетворяющую международным фармстандартам. Завод, постройка которого заняла бы приблизительно три года — как раз к моменту глобальной доступности «Олигоманната», — смог бы покрывать нужды 2 млн пациентов ежегодно [8]. В середине июля 2020 года состоялся официальный запуск строительства этого объекта площадью 55 тыс. кв. м и стоимостью 1,227 млрд юаней (187 млн долларов) [9] [10].
В начале ноября 2020 года «Грин Валли» приступила к набору участников в GREEN MEMORY. Столь важное событие было с большим воодушевлением прокомментировано Джеффри Каммингсом (Jeffrey Cummings), всемирно известным исследователем болезни Альцгеймера, на счету которого восемь сотен научных публикаций, четыре десятка книг и руководство множеством клинических испытаний [11] [12].
В середине мая 2022 года «Грин Валли» уведомила о досрочном прекращении GREEN MEMORY, затраты на проведение которого оценивались в 4 млрд юаней (600 млн долларов) и которое уже успело рандомизировать 439 пациентов. Фармкомпания сослалась на чрезвычайно негативное влияние пандемии коронавирусной инфекции COVID-19, которая как не позволила людям должным образом посещать центры проведения исследования, так и сдержала возможность выхода предприятия на фондовый рынок в целях привлечения дополнительного капитала, необходимого для финансирования продолжения испытания. «Грин Валли» также сообщила, что обязательно вернется к этому вопросу, когда наступит более благоприятная обстановка [13] [14] [15] [16].

«ОЛИГОМАННАТ»: ВОЛНА НЕДОВЕРИЯ
Отношение мирового научного сообщества к «Олигоманнату» (Oligomannate, олигоманнат натрия) пропитано явным скепсисом. Экспертов понять можно, поскольку любой терапевтический прорыв в столь лекарственно непробиваемой патологии, как болезнь Альцгеймера, заставляет пристально и натужно искать подвох. Опять же, механистически (и успешно!) связать микробиоту с нейродегенеративными процессами — нечто из области фантастики.
#1
Олигоманнат натрия (sodium oligomannate, GV-971) продемонстрировал улучшения на абсолютных 2,70 балла по шкале ADAS-Cog12, притом что для клинически значимой результативности необходимо добиться хотя бы 3 баллов [1]. Кроме того, расчеты по этой шкале характеризуются существенной вариативностью [2], и потому необходимы дополнительные сведения, какая именно модель была выбрана в случае препарата.
#2
Болезнь Альцгеймера слишком тяжела и стремительна в своем прогрессировании, чтобы суметь выйти к явному расхождению с группой плацебо за какой-то жалкий месяц лечения. Изумление также вызывает внезапно большой разрыв с группой плацебо в промежутке 24 и 36 недель терапии, когда в контрольной группе наблюдалось слишком резкое ухудшение состояния всех испытуемых.
#3
Эффективность и безопасность «Олигоманната» были изучены в течение девяти месяцев, чего явно недостаточно для безоговорочных выводов о долгосрочных перспективах лечения болезни Альцгеймера. Тот же донепезил (donepezil) лишь в самом начале терапии сдерживает ухудшение когнитивных функций на приемлемом уровне (разница с плацебо по шкале ADAS-Cog составляет от 2,7 до 3,1 пункта) — затем угол наклона кривой по сути не отличается от плацебо [1] [2].
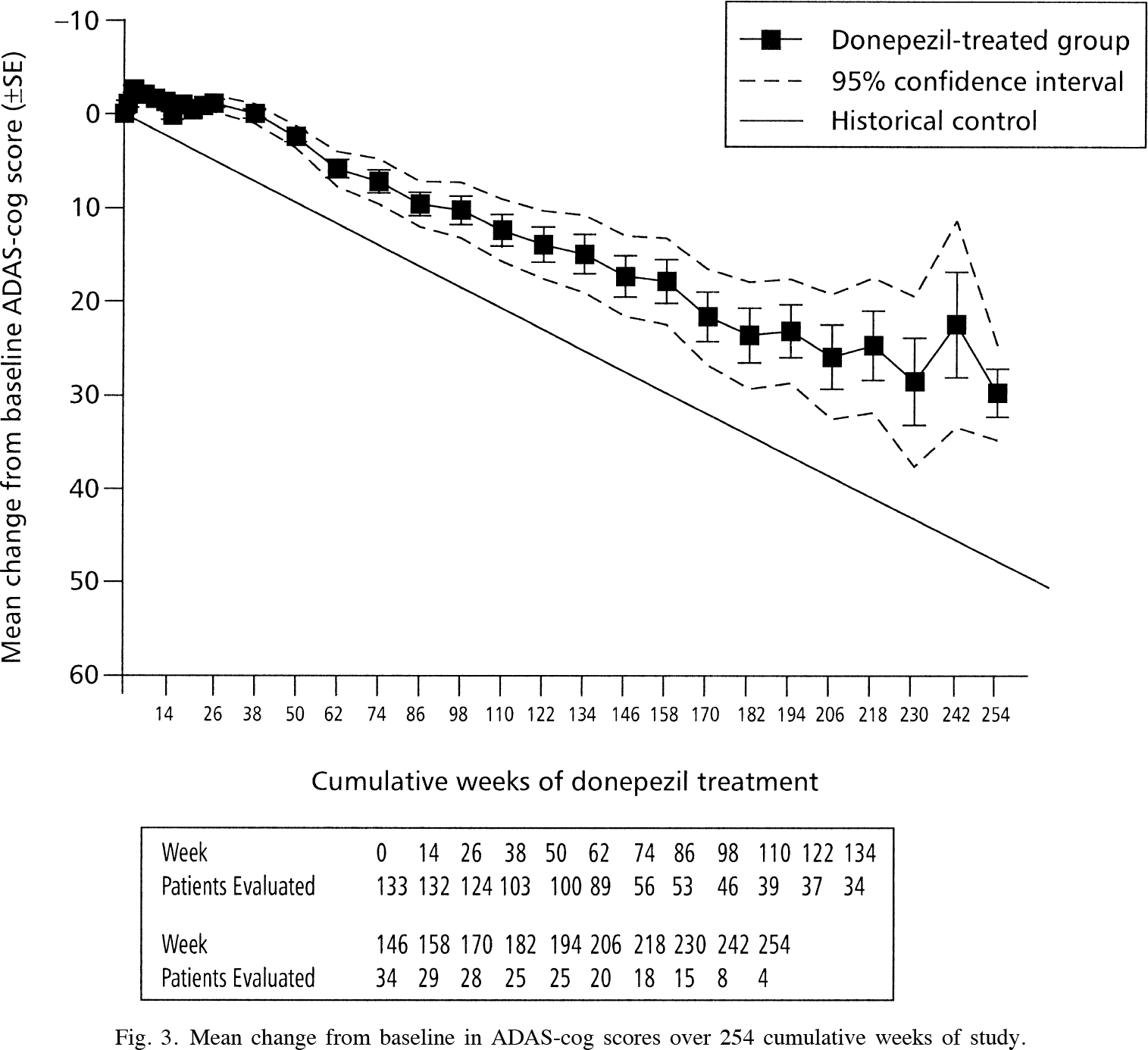
#4
В предшествовавшем клиническом испытании NCT01453569 фазы II (рандомизированном, двойном слепом, плацебо-контролируемом, многоцентровом), охватившем популяцию пациентов (n=242), аналогичную выборке больных в регистрационном испытании NCT02293915 фазы III (рандомизированном, двойном слепом, плацебо-контролируемом, многоцентровом), назначение олигоманната натрия в ежедневных дозах 600 или 900 мг на протяжении 24 недель обеспечило иные результаты, нежели продемонстрированные в последнем [1].
Так, не было выявлено статистически значимой разницы с плацебо по шкале ADAS-Cog12 (p=0,886 и p=0,302). Тем не менее в подгруппе 900-мг дозы препарата абсолютное улучшение составило 2,56 пункта, что недалеко ушло от абсолютного улучшения на 2,70 пункта в регистрационном исследовании. Следует также понимать, что в первом испытании исходные баллы MMSE [больше — лучше] и ADAS-Cog12 [меньше — лучше] составляли 17,5–18,3 и 26,1–28,1 пункта — против 19,4–19,5 и 20,9–21,3 пункта соответственно во втором, то есть в регистрационное исследование попали менее тяжелые пациенты, у которых когнитивные способности изначально были нарушены не столь серьезно.
В подгруппе 900-мг дозы всё же было установлено статистически значимое расхождение с точки зрения шкалы CIBIC+ (p=0,014). Экспериментальная терапия также проявила себя, во-первых, улучшением метаболизма глюкозы в некоторых областях головного мозга (ее прогрессирующий гипометаболизм коррелирует с тяжестью симптомов при болезни Альцгеймера) и, во-вторых, засвидетельствовала рост концентрации Aβ1–42 в спинномозговой жидкости, тем самым отразив желаемый антиагрегантный клиренс нейротоксичного бета-амилоида.

#5
Коль уж олигоманнат натрия настолько хорошо справляется со сдерживанием прогрессирования когнитивного расстройства при болезни Альцгеймера, уместно и логично провести его прямое сравнение не с плацебо, а с каким-либо иным одобренным препаратом, доказанно и гарантированно работающим в случае легко-умеренной формы заболевания. То есть необходимо клиническое исследование не меньшей эффективности.
#6
Красным флагом выступает сам факт появления до такой степени инновационного лекарства в авторитарном Китае, где соблюдение международных стандартов качества, в том числе касающихся проведения клинических испытаний, по-прежнему находится под большим вопросом.
Что говорить, если в 2007 году сама «Шанхай Грин Валли фармасьютикалс» (Shanghai Green Valley Pharmaceuticals) была уличена в мошенническом продвижении выпускаемого ею противоракового медикамента на основе гриба трутовик лакированный (Ganoderma lucidum), позиционируемого чуть ли не панацеей от любых онкологических заболеваний [1]. (На постсоветском пространстве известен под такими названиями, как «Линчжи», «Рейши», «Гриб бессмертия».)
Разбирательства установили, что препарат, относящийся к традиционной китайской медицине и повсеместно рекламировавшийся в газетах и на телевидении, не обладает теми заявленными чудодейственными противоопухолевыми и иммуномодулирующими свойствами, которые позволили бы выбрать его в качестве замены стандартной первоочередной химиотерапии. Однако G. lucidum всё же может применяться в качестве альтернативного дополнения к традиционному лечению, учитывая его потенциал усиления противоопухолевого ответа и стимулирования иммунной системы [2].
«Грин Валли» заработала свыше 800 млн юаней (122 млн долларов) на продажах G. lucidum только за один год, когда 200-граммовая упаковка препарата продавалась за 1590 юаней (240 долларов) и требовалось не менее трех курсов лечения стоимостью 25 тыс. юаней (3800 долларов).
#7
Гэн Мэйюй (Geng Meiyu, 耿美玉), изобретательница «Олигоманната», похоже, не стесняется обращаться к практикам манипулирования данными и фальсифицирования иллюстраций в статьях, публикуемых в рецензируемых научных журналах. Во всяком случае это следует из разборов на площадке анонимного комментирования научных публикаций PubPeer [1]. Этим же грешат и ее коллеги из Государственной лаборатории исследований лекарственных средств при Шанхайском институте фармакологии Китайской академии наук [2] [3] [4] [5]. Впрочем, мало кому из ученых по всему миру удается не прибегнуть к подобному соблазну во имя представления результатов в наилучшем свете.
#8
«Грин Валли» вчистую нарушает корпоративную этику, занимаясь удалением задним числом собственных же пресс-релизов. Так, на ее корпоративном сайте больше нет объявления о прекращении международного клинического испытания GREEN MEMORY. Справедливости ради, соответствующая новость всё же была перенесена на продуктовый промо-сайт «Олигоманната» [1].
#9
Нельзя исключать того, что Пекин одобрил «Олигоманнат» ввиду стремительно нагнетающегося противостояния с Соединенными Штатами в области торговли и технологий: коммунистические бонзы счастливы лишний раз позлить американское правительство, десятилетиями вбухивающее огромные деньги в безуспешную борьбу с болезнью Альцгеймера, деменцию и ее устрашающие последствия.
#10
Настоящую информационную войну против Гэн Мэйюй и ее «Олигоманната» затеял Жао И (Rao Yi, 饶毅), уважаемый китайский нейробиолог, основатель двух институтов исследования мозга и президент Столичного медицинского университета (Capital Medical University, CUM, Пекин, Китай), известный своей активной позицией в отношении реформы науки и сопряженных дисциплин [1].

Начиная с осени 2019 года, Жао распространял в профильных сообществах социальных сетей сообщения, что «Олигоманнат» — это фейковое лекарство: якобы невозможно лечить болезнь Альцгеймера путем модуляции кишечной микробиоты.
Летом 2020 года в журнале Cell Research, в котором Жао входит в редакционный совет, появилась его заметка [2] с критикой вышедшей осенью 2019-го в этом же издании публикации о механизме действия олигоманната натрия с привязкой к болезни Альцгеймера [3]. По подсчетам ученого, команда Гэн Мэйюй, начиная с 2003 года, подготовила двенадцать работ, которые имели отношение к этому препарату и родственным ему соединениям и в которых описывались совершенно иные механизмы действия, причем без какого-либо намека на прямую модуляцию кишечной микробиоты.
Так, олигоманнат натрия, как описывает Гэн и ее коллеги, лечит болезнь Паркинсона на животных моделях [4]; непосредственно связывается с бета-амилоидными пептидами [5] [6]; защищает нейроны от токсичности бета-амилоида [5] [7]; смягчает потерю памяти, вызванную введением бета-амилоидного пептида в головной мозг [8]; напрямую ингибирует индуцированную H2O2 гибель нейронов [9]; ослабляет вызванное скополамином ухудшение памяти у крыс [9]; действует на астроциты in vitro [10]; связывается с белками внутри нейронов [11].
По мнению Жао, это попросту невозможно! Если ранее олигоманнат натрия, как утверждала Гэн, оказывал прямое воздействие на бета-амилоидный пептид или непосредственно на нейроны или глиальные клетки — всё внутри нервной системы, то сейчас она постулирует, что он благотворно влияет на болезнь Альцгеймера косвенным образом — посредством регуляции микробиоты кишечника и воспаления. Опять же, получается, что молекула взаимодействует со слишком большим количеством мишеней, важных в задаче лечения этого заболевания. А ведь в биомедицине чрезвычайно редко встречаются препараты, которые нацелены на такое изобилие мишеней — и всё множество последних каким-то чудесным и невероятным образом работает совместно и согласованно в рамках лечения одного заболевания, причем без сопутствующих нежелательных явлений, которых однозначно не может не быть. Ученый выказал удивление, почему в публикации Гэн, описывающей модуляцию оси «кишечник — мозг» при помощи олигоманната натрия, нет ни одной ссылки на вышеуказанную дюжину статей.
В ответ на критику Гэн Мэйюй через всё тот же Cell Research сообщила, что непрерывное развитие медицинской науки дало возможность иначе взглянуть на механизм действия олигоманната натрия, а прошлые публикации по этой теме, о которых упомянул Жао, имеют слишком мало отношения к эффектам модуляции оси «кишечник — мозг», чтобы на них ссылаться [12]. Она привела противодиабетический метформин в качестве примера лекарственного соединения с многогранным механизмом действия, затрагивающим, казалось бы, совершенно разнородные сигнальные пути для реализации должного гликемического контроля.
Жао И не успокоился, разразившись претензиями в своем блоге. Профессор был в ярости. Мол, если раньше Гэн говорила, что олигоманнат натрия действует на нервные и глиальные клетки головного мозга, то сейчас заявляет, что препарат работает через кишечную микробиоту, и именно последний механизм действия является ключевым в лечении болезни Альцгеймера. Возникает резонный вопрос: почему результаты доклинических исследований, собранные на основе совершенно разных механизмов действия одного препарата, в целом не отличаются и не противоречат друг другу? [13]
В конце января 2021 года Министерство науки и технологий Китая уведомило, что не обнаружило каких-либо фальсификаций в статьей Гэн Мэйюй о модуляции оси «кишечник — мозг» олигоманнатом натрия, разве что были установлены незначительные проблемы с иллюстративным материалом [14].
В итоге стороны отправились в суд, который в середине декабря 2021 года постановил, что законные академические споры и критика должны проясняться с точки зрения развития медицины, и все сопутствующие им вопросы следует решать путем научной дискуссии и дебатов, предполагающих публикацию исходных данных и проведение повторных экспериментов [15]. При этом суд отклонил претензии истца в лице Гэн Мэйюй, которая обвинила ответчика в лице Жао И в злонамеренной клевете и распространении неподтвержденной ложной информации, что повлекло за собой нанесение ущерба ее репутации как ученого, негативно отразилось на бизнесе «Грин Валли» и ввело общественность в заблуждение [16]. Тем не менее суд указал, что Жао преступил черту, обратившись к чрезмерной риторике и неуместным в научной среде методам критики, хотя и имеет полное право комментировать результаты чужих исследований, основываясь на собственных знаниях и опыте.
Когда стало известно, что «Грин Вали» приняла решение свернуть масштабную клиническую проверку «Олигоманната» на международной арене, Жао И не преминул указать на собственную правоту в бесконечной критике этого препарата: якобы данный поступок фармкомпании — очевидное свидетельство того, что олигоманнат натрия как был, так и продолжает оставаться фейковым лекарством [17].
По мнению ученого, «Грин Валли» было чрезвычайно важно продемонстрировать всему мировому сообществу свою будто бы высокую заинтересованность в выводе «Олигоманната» за пределы Китая: фармпроизводитель давал понять, что абсолютно уверен в механизме действия лекарства. Однако всё дальнейшее было предрешено и просчитано заранее: вначале анонсируется нужное опорное клиническое испытание GREEN MEMORY, затем оно запускается, а некоторое время спустя сообщается, что исследование прекращается по независящим причинам, к примеру, как заявила «Грин Валли», из-за пагубных для логистики последствий ковида и недостаточности финансирования. Таким образом, считает Жао И, можно и дальше продолжать торговать «Олигоманнатом» на и без того огромном, высокоприбыльном и коррумпированном внутреннем рынке Китая, оставляя в неведении врачей и пациентов из мира Запада.
В середине июля 2023 года суд поставил точку в многолетних разбирательствах между учеными: апелляция Гэн Мэйюй отклонена — решение обжалованию не подлежит [18]. Жао И поприветствовал судебный вердикт очередной разгромной публикацией: «Вероятность того, что олигоманнат натрия является настоящим лекарством, меньше, чем вероятность того, что Гэн Мэйюй — китайский Эйнштейн» [19].
Приведем основные тезисы Жао, свидетельствующие далеко не в пользу «Олигоманната». Пусть они местами умозрительны и склонны к теоретизации, но принять их к пристальному и рассудительному вниманию не помешает.
1
За последнее столетие развития современной фармацевтической индустрии Китай, несмотря на открытые им важные препараты, такие как артемизинин и триоксид мышьяка, в основном фокусировался на лечении менее серьезных заболеваний и болезней бедности. В области решения сложных глобальных медицинских проблем Китай пока не создал ни одного прорывного лекарства мирового уровня. Это не означает невозможность такого достижения в будущем, но научный прогресс, как правило, происходит постепенно.
Понятное дело, гении существуют, и они могут родиться как на Западе, так и в Китае. Если экстраполировать вероятность рождения гения уровня Эйнштейна, оценочно составляющую раз в 300–400 лет, то, учитывая огромное население Китая, столь выдающийся ученый, как Гэн Мэйюй, мог бы рождаться раз в столетие.
2
В 1997 году Гэн Мэйюй, вернувшаяся из Японии, начала свою трудовую деятельность в Китайском океанологическом университете (Ocean University of China, 中国海洋大学, Циндао, пр. Шаньдун, Китай) — учреждении, во-первых, на тот момент по сути бедствующем и, во-вторых, никак не специализирующемся на фармацевтике или медицине, — и буквально в первый же год открыла олигоманнат натрия. В те годы руководство университета активно поощряло своих сотрудников искать дополнительные источники финансирования.
В условиях чрезвычайно ограниченных бюджетов и отсутствия профильной экспертизы шансы создания революционного препарата крайне малы: вероятность подобного успеха вряд ли превышает 1%.
3
Идея «поиска лекарств в океане» звучит, безусловно, привлекательно. Однако если бы всё было так просто, мировая фармацевтическая индустрия давно бы уже решила массу глобальных проблем, ведь все лекарства уже «созданы» морскими пучинами. Ну а пока странам Запада на разработку нового препарата приходится тратить в среднем десять лет и вкладывать минимум один миллиард долларов инвестиций.
Заявление о создании эффективного лекарства против болезни Альцгеймера при наличии бюджета менее миллиона долларов вызывает серьезные сомнения: вероятность такого события можно условно оценить как 1 из 100 000.
4
В научной публикации, которая описывает предполагаемый механизм действия олигоманната натрия, отсутствуют ссылки на 12 предшествующих работ, прямо или косвенно относящихся к этому препарату. Это, возможно, свидетельствует о несоответствиях или противоречиях между ранними и поздними исследованиями.
Гэн Мэйюй, как ведущий автор статьи, объясняет, что прочие работы «не являются достаточно релевантными». Однако если единственные собственные исследования, связанные с олигоманнатом натрия, недостаточно релевантны, то какие тогда исследования можно считать таковыми? Более логичное объяснение заключено в том, что прошлые публикации противоречат друг другу, и поэтому их сознательно скрыли от рецензентов.
Какая из версий кажется более достоверной?
5
Особую настороженность вызывает резкое изменение описания механизма действия олигоманната натрия: от первоначального утверждения о прямом воздействии на нервную систему до более поздних и по-настоящему внезапных заявлений о влиянии на нее посредством кишечной микрофлоры — после того как у регулятора возникли вопросы о способности этой относительно крупной молекулы преодолевать гематоэнцефалический барьер.
Какова вероятность того, что это действительно научный прорыв, а не попытка подогнать данные под новые требования?
6
Предположим, олигоманнат натрия действительно работает. Тогда он подтвердил бы сразу три гипотезы, которые до сих пор остаются спорными в научной среде: 1) кишечная микрофлора имеет значительное влияние на головной мозг; 2) воспалительные процессы играют ключевую роль в развитии болезни Альцгеймера; 3) лекарственное средство, воздействующее на кишечную микрофлору, может эффективно лечить болезнь Альцгеймера.
Перед нами, похоже, исторический прорыв не только в лечении болезни Альцгеймера, но и в понимании патофизиологии этого заболевания!
7
Научная методология Гэн Мэйюй демонстрирует тенденцию следования популярным гипотезам: первоначально акцент делался на бета-амилоидном пептиде, затем, после появления новых теорий о роли микробиома кишечника и воспаления в патогенезе болезни Альцгеймера, механизм действия олигоманната натрия вдруг был «переориентирован» на эти мишени.
Следует ли считать это проявлением научной гибкости или просто очередной попыткой угадать тренд?
8
Симптоматика болезни Альцгеймера, особенно на ранних ее стадиях, чрезвычайно сложно поддается объективной оценке, а диагностика зачастую основывается на субъективных отчетах пациентов о состоянии памяти или примитивных и не всегда точных тестах, подверженных влиянию внешних факторов и суггестии медицинского персонала.
Опубликованные Гэн Мэйюй результаты клинического испытания фазы III демонстрируют отсутствие статистически значимых различий между группами плацебо и олигоманната натрия в течение первых 24 недель терапии, с внезапным появлением существенной разницы на 36-й неделе. Примечательно, что этот эффект обусловлен резким ухудшением показателей в группе плацебо.
Следует напомнить, что плацебо — это вещество, которое внешне идентично проверяемому препарату, но не обладает никаким терапевтическим действием. В клинических исследованиях плацебо используется для проверки истинной эффективности препарата, так как пациенты могут психологически «чувствовать улучшение», даже если получают пустышку.
Что же более вероятно: достоверность таких «результатов» или возможность манипуляций и нарушений в ходе исследования — допустим, преднамеренное информирование пациентов, что они выдают плацебо?
9
Диагностика ранних стадий болезни Альцгеймера крайне сложна, а ее прогрессирование строго индивидуально для каждого пациента: даже при наличии одинаковых симптомов время начала заболевания может различаться на годы, как и темпы его развития. Тем не менее в отчетах Гэн Мэйюй утверждается, что олигоманнат натрия демонстрирует одинаковую эффективность у всех пациентов в течение строго определенного периода — между 24-й и 36-й неделями лечения.
Какова вероятность того, что терапевтический эффект препарата проявляется со столь точной синхронностью в условиях гетерогенности течения болезни Альцгеймера?
10
Доклинические исследования олигоманната натрия на животных моделях болезни Альцгеймера были проведены на крайне малой выборке: всего 12 мышей в экспериментальной группе и 19 в контрольной. Для препарата, потенциально предназначенного для миллионов пациентов, такой объем доклинических исследований представляется недопустимо малым.
Какими намерениями руководствовались в данном случае: искренним желанием помочь пожилым людям или стремлением «Грин Валли» как можно скорее начать извлекать прибыль?
11
В доклиническом исследовании влияния олигоманната натрия на болезнь Паркинсона использовались еще меньшие группы: 5 мышей в экспериментальной группе — в сравнении с 6 мышами в контрольной группе.
Если Гэн Мэйюй действительно верит в «чудодейственность» олигоманната натрия, то почему до сих нет результатов его клинической проверки среди пациентов с болезнью Паркинсона?
12
Помпезно анонсированное международное клиническое испытание, предполагающее более строгие стандарты и повышенную прозрачность, было внезапно прекращено под предлогом пандемии коронавирусной инфекции COVID-19, хотя набор пациентов начался в период более строгих эпидемиологических ограничений. Многие не знают, что некоторые фармацевтические компании Китая лишь делают вид, будто бы проводят международные исследования, дабы создать иллюзию авторитетности для привлечения доверия внутри страны.
Сейчас, когда пандемия завершена, планирует ли вообще «Грин Валли» возобновить испытание?
13
«Олигоманнат» разрешен к продаже в Китае, но с условием, что «Грин Валли» продолжит сбор данных о его эффективности. Однако если такие данные накапливаются без контрольной группы (например, просто на основании субъективных отчетов пациентов), это не является достоверным научным доказательством и может быть лишь очередной формой подтасовки. Многие сотрудники Национального управления по контролю за медицинской продукцией (NMPA) изначально относились с большим скепсисом к эффективности олигоманната натрия, но были вынуждены одобрить препарат под давлением свыше.
Требование собирать данные после начала продаж — это форма компромисса, свидетельствующая о сомнениях регулятора, не так ли?
Жао также сообщил, что владеет инсайдерской информацией, полученной от людей из биомедицинской отрасли, специалистов по болезни Альцгеймера и лиц, вовлеченных в проекты «Грин Валли»: якобы олигоманнат натрия — не более чем наукообразная подделка, фальсификат и пустышка. И если в последние годы в фармкомпанию стекалось много людей, то сейчас многие начали увольняться, кто-то по собственной воле, а кто-то по принуждению. Те, кто уходил добровольно, делали это из-за опасений быть скомпрометированными участием в сомнительном проекте «Олигоманната», который запятнает их профессиональную репутацию.
«Болезнь Альцгеймера — одно из самых неприемлемых заболеваний, которое ложится тяжелейшим бременем на семьи и общество. Я узнала о болезни Альцгеймера в Японии, и после возвращения в Китай много работала над ее проблемой. Но я не рассчитывала обязательно создать лекарство, лишь надеялась на какие-то плоды от активных исследований. И вот, теперь появилась надежда. Но для этого пришлось пройти невероятно длинный и сложный путь, путь одиночества и непонимания».
Гэн Мэйюй (Geng Meiyu, 耿美玉).
«ОЛИГОМАННАТ»: ДИЛЕММА БИОМЕДИЦИНСКОЙ ЭТИКИ
В сложившейся неоднозначной ситуации с «Олигоманнатом» (Oligomannate, олигоманнат натрия) биомедицинское сообщество столкнулось с дилеммой: либо продолжать восхвалять «гениальное» изобретение и позволять недобросовестным лицам наживаться на продаже препарата с недоказанной эффективностью, либо предпринять меры для пресечения подобной практики.
Существует множество способов уклониться от ответственности. Сотрудники Шанхайского института фармакологии, обладающие внутренней информацией, сделают вид, что их это не касается. Врачи, участвовавшие в клинических испытаниях олигоманната натрия (sodium oligomannate, GV-971) в Китае, займут позицию стороннего наблюдателя. Специалисты, покинувшие «Шанхай Грин Валли фармасьютикалс» (Shanghai Green Valley Pharmaceuticals) из-за несогласия с ее методами работы, просто промолчат. И, наконец, многие эксперты, представители регулирующих органов и другие информированные лица предпочтут остаться в стороне.
Однако возникает главный вопрос: возможно ли заглушить голос совести? Могут ли честные люди спокойно наблюдать за тем, как пожилые пациенты с болезнью Альцгеймера и их семьи тратят свои ограниченные доходы и средства государственной медицинской страховки, тем самым финансируя абсолютно беспринципных дельцов?
И всё же критикам «Олигоманната» уместно напомнить поучительный пример артемизинина (artemisinin) и его производных. Лекарственное соединение, открытое в 1970-х гг. китайским фармакологом Ту Юю (Tu Youyou, 屠呦呦), вначале было поднято на смех западным научным сообществом. И правда: выделить сверхэффективный противомалярийный препарат, названный цинхаосу (qinghaosu, 青蒿素), из полыни однолетней (Artemisia annua) на основе рекомендаций древней книги по традиционной китайской медицине (ТКМ) — это утопия [1]. В 2015 году Ту Юю была награждена Нобелевской премией по физиологии и медицине [2].
Не менее любопытна история с триоксидом мышьяка (arsenic trioxide), который, несмотря на свою высокую токсичность, с древнейших времен используется в ТКМ, и который, благодаря усилиям китайского ученого Чжана Тиндуна (Zhang Tingdong, 张亭栋), стал успешно применяться в лечении острого промиелоцитарного лейкоза [3].
Если «Олигоманнат» и правда является чудо-лекарством, а не псевдонаучным фарсом и сущим мошенничеством, это означает, что для изобретения чего-либо подобного, наделенного удивительно целительной силой, достаточно простого эмпирического подхода.
Если же олигоманнат натрия окажется крупнейшей фармацевтической фальсификацией XXI века, история всенепременно зафиксирует, что неравнодушные и добросовестные ученые били тревогу. Ну а китайское правительство, бессердечное на расправу, строго накажет всех виновных в обмане государственной страховой системы: либо на долгие годы упрятав Гэн Мэйюй и всех причастных в тюрьму, либо приговорив их к высшей мере наказания. Тогда рождается вопрос: неужели «Грин Валли» готова к столь серьезному риску, когда жажда наживы перевешивает все страхи?
«ОЛИГОМАННАТ»: ШИРОКИЙ ТЕРАПЕВТИЧЕСКИЙ ПОТЕНЦИАЛ
«Шанхай Грин Валли фармасьютикалс» (Shanghai Green Valley Pharmaceuticals) продолжает шокировать консервативное западное научное сообщество, выдавая на-гора всё новые потенциальные медицинские применения для «Олигоманната» (Oligomannate, олигоманнат натрия), убедительно доказывая, как благотворная модуляция оси «кишечник — мозг», реализуемая олигоманнатом натрия (sodium oligomannate, GV-971), помогает в лечении и профилактике заболеваний за пределами болезни Альцгеймера.
«ОЛИГОМАННАТ»: ПРОТИВ БОЛЕЗНИ ПАРКИНСОНА
В середине июня 2021 года «Грин Валли» сообщила, что особенности механизма действия «Олигоманната» позволяют предполагать его пригодность в лечении других заболеваний нейродегенеративной природы, включая болезнь Паркинсона, сосудистую деменцию, нейромиелит зрительного нерва со спектральным расстройством (NMOSD), боковой амиотрофический склероз (БАС) [1].
Согласно результатам доклинических исследований на животных моделях болезни Паркинсона, олигоманнат натрия, восстанавливающий патологически нарушенный баланс микробиоты кишечника, не только предотвращал агрегацию токсичного альфа-синуклеина, но даже разрушал предварительно агрегированный альфа-синуклеин. Препарат уменьшал его отложения в кишечнике и головном мозге, снижал нейровоспаление, защищал дофаминергические нейроны и улучшал моторные и немоторные симптомы [2].
В середине января 2022 года FDA выдало «Грин Валли» разрешение на проведение клинического испытания олигоманната натрия для лечения болезни Паркинсона, которой страдают не менее 10 млн человек во всём мире [3] [4].
Запланированное 36-недельное клиническое испытание фазы II (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое, международное) должно было пригласить пациентов (n=300) с болезнью Паркинсона на ранней стадии из Северной Америки и Азиатско-Тихоокеанского региона. По завершении исследования к проведению была намечена открытая 36-недельная проверка.
Ранее, в начале 2021 года и в конце 2021-го, в Китае были зарегистрированы два клинических испытания, ChiCTR2100042680 (n=150) и ChiCTR2100053873 (n=84), которые собирались проверить олигоманнат натрия при болезни Паркинсона: соответственно изучить его эффективность в отношении моторных и немоторных симптомов и его способность снижать уровни легких цепей белков нейрофиламентов (NFL) и альфа-синуклеина, а также ослаблять T1h-воспаление.
Между тем дальнейших известий о ходе ни одного из указанных исследований пока не поступало.
«ОЛИГОМАННАТ»: ПРОФИЛАКТИКА ПОСТИНСУЛЬТНЫХ КОГНИТИВНЫХ НАРУШЕНИЙ
Больница Наньфан при Южном медицинском университете (Southern Medical University, SMU, 南方医科大学, Гуанчжоу, пр. Гуандун, Китай) планировала 24-недельное клиническое испытание NCT05545605 (рандомизированное, двойное слепое, плацебо-контролируемое), поставившее своей целью проверить гипотезу, способен ли «Олигоманнат» сдерживать или даже предотвращать развитие когнитивных нарушений у взрослых пациентов (n=116) после острого ишемического инсульта.
Исследование должно было завершиться к концу 2023 года, однако каких-либо известий пока не поступало.
«ОЛИГОМАННАТ»: ЛЕЧЕНИЕ ТЯЖЕЛОГО ОСТРОГО ПАНКРЕАТИТА
На мышиных моделях тяжелого острого панкреатита — смертельно опасного воспалительного состояния с чрезвычайно ограниченными возможностями лечения — было показано, как именно олигоманнат натрия устраняет воспаление поджелудочной железы [1].
«Олигоманнат», меняющий микробиоту кишечника, способствует росту популяции бактерий Faecalibacterium и модуляции периферической и кишечной иммунной системы. Согласно метаболомному анализу, выявлен рост короткоцепочечных жирных кислот, включая пропионат и бутират, — ключевых метаболитов, которые, благодаря блокированию сигнального пути MAPK, препятствуют поляризации макрофагов M1. В результате была подавлена инфильтрация нейтрофилов в поджелудочной железе, что привело к разрешению ее воспаления с последующим ослаблением системного воспалительного ответа.

«ОЛИГОМАННАТ»: ЛЕЧЕНИЕ НЕЙРОМИЕЛИТА ЗРИТЕЛЬНОГО НЕРВА СО СПЕКТРАЛЬНЫМ РАССТРОЙСТВОМ
На двух мышиных моделях нейромиелита зрительного нерва со спектральным расстройством (NMOSD) — воспалительного демиелинизирующого заболевания, поражающего в первую очередь зрительные нервы и центральную нервную систему, — было показано, как олигоманнат натрия значительно изменил микробиоту кишечника, ослабил периферическое воспаление и метаболические нарушения, облегчил нейровоспаление в спинном мозге [1].
Учитывая, что олигоманнат натрия обладает крайне низкой биодоступностью и локализуется преимущественно в кишечном тракте, его роль в ремоделировании коллективного сообщества микроорганизмов кишечного микробиома и периферических нарушений является, видимо, решающей в смягчении нейровоспаления. Тем не менее нельзя отвергать возможность того, что препарат подавляет нейровоспаление непосредственным образом. Согласно метаболомному анализу, олигоманнат натрия изменил уровень таких ключевых метаболитов, как индолы, пирролидины, аденозины.
«ОЛИГОМАННАТ»: ЛЕЧЕНИЕ СИНДРОМА ПОЛИКИСТОЗА ЯИЧНИКОВ
На мышах с синдромом поликистоза яичников, индуцированным летрозолом, применение олигоманната натрия привело к улучшению метаболизма глюкозы и смягчению аномального метаболизма желчных кислот, частичному разрешению эндокринных нарушений, включая гиперинсулинемию и гиперандрогенемию, восстановлению фертильности и росту числа помётов. Назначение олигоманната натрия определило значительное увеличение разнообразия кишечной микробиоты на фоне снижения относительной численности бактерий Firmicutes. [1]
«ОЛИГОМАННАТ»: ЛЕЧЕНИЕ ОЖИРЕНИЯ
В конце 2023 года было зарегистрировано клиническое испытание ChiCTR2300078993, проводимое Аффилированной больницей мозга при Медицинском университете Гуанчжоу (Guangzhou Medical University, GMU, GZHMU, 广州医科大学, Гуанчжоу, пр. Гуандун, Китай) среди взрослых (25–45 лет) пациентов (n=30) с избыточной массой тела или ожирением (индекс массы тела [ИМТ] ≥ 24 кг/м2), которым на протяжении 3 месяцев назначают олигоманнат натрия или плацебо. Первичной конечной точкой эффективности лечения установлено изменение веса.