ЧТО ПРОИЗОШЛО
«Либолви» (Lybalvi, оланзапин + самидорфан) — новый лекарственный препарат, предназначенный для лечения шизофрении или биполярного расстройства I типа у взрослых.
ОСНОВНЫЕ ФАКТЫ
Ирландская «Алкермес» (Alkermes) построила «Либолви» вокруг широко используемого и эффективного нейролептика оланзапина (olanzapine), добавив к нему самидорфан (samidorphan) в целях сдерживания увеличения массы тела, вызываемого оланзапином.
В случае биполярного расстройства I типа «Либолви» может применяться равно как для купирования острых маниакальных или смешанных эпизодов (монотерапевтически или как добавочный препарат к литию или вальпроату), так и в рамках поддерживающей монотерапии.
Пероральный «Либолви» назначается один раз в день.
Регуляторное разрешение на «Либолви» выдано Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в конце мая 2021 года [1].
В Европе «Либолви» не одобрен.
В России «Либолви» регистрацию не получал, хотя должные клинические испытания проводились. Очевидно, изменившаяся геополитическая обстановка закрыла для него двери.
Для незастрахованных американских пациентов или тех, чья медицинская страховка не покрывает расходы на «Либолви», стоимость 30-дневного курса лечения составляет 1600 долларов.

ПРЯМАЯ РЕЧЬ
«Шизофрения и биполярное расстройство I типа являются сложными хроническими заболеваниями, постоянно требующими новых лекарств, доказанно работающих. Учитывая высокую эффективность оланзапина, но и его выраженное нежелательное явление в виде роста массы тела, появление „Либолви“ стало желанным дополнением к арсеналу существующих препаратов».
Рене Кан (René Kahn), заведующий отделения психиатрии и поведенческой системы здоровья Школы медицины Икан при Маунт-Синай (ISMMS, Нью-Йорк, США).
«Мы всецело приветствуем появление нового лечения, которое, сохранив высокую эффективность, почти избавило его от обременительного нежелательного явления».
Пол Джионфриддо (Paul Gionfriddo), президент и генеральный директор некоммерческой организации «Психическое здоровье Америки» (Mental Health America, MHA).
«„Либолви“ — новый важный вариант лечения шизофрении и биполярного расстройства I типа, который, мы уверены, будет с восторгом принят как самими пациентами, так и их врачами и опекунами».
Ричард Попс (Richard Pops), председатель совета директоров и исполнительный директор «Алкермес» (Alkermes).
СУТЬ ВОПРОСА
Шизофрения, которая считается одной из десяти ведущих причин инвалидизации населения во всём мире, характеризуется нарушением психических процессов [1] [2].
Это психическое расстройство, которое начинается в позднем подростковом или раннем взрослом возрасте и распространенность которого в течение жизни составляет 1%, связано с огромным экономическим бременем и сравнительно меньшей продолжительностью жизни [1] [2] [3] [4].
Для лечения шизофрении предложено большое разнообразие антипсихотических препаратов. К ним относятся антагонисты дофаминовых D2-рецепторов — хлорпромазин (chlorpromazine), трифлупромазин (triflupromazine), прохлорперазин (prochlorperazine) и галоперидол (haloperidol), блокаторы серотониновых 5HT2A-рецепторов с D2-антагонизмом — клозапин (clozapine), оланзапин (olanzapine), кветиапин (quetiapine) и рисперидон (risperidone), частичные D2-агонисты — арипипразол (aripiprazole) и брекспипразол (brexpiprazole).
Все эти нейролептики вызывают эндокринологические и метаболические побочные эффекты, такие как увеличение веса, гиперлипидемия, гипергликемия, гипертония. Они являются факторами риска развития сердечно-сосудистых заболеваний, а также вносят основной вклад в раннюю и повышенную смертность пациентов, страдающих тяжелыми психическими заболеваниями и принимающих антипсихотики [5].
КАК ЭТО РАБОТАЕТ
«Либолви» (Lybalvi, ALKS 3831) представляет собой сочетание атипичного антипсихотика оланзапина (olanzapine) и опиоидного антагониста самидорфана (samidorphan).
Механизм действия оланзапина, антипсихотика второго поколения, точно не установлен. Он эффективен в устранении как позитивных, так и негативных симптомов [1] [2]. Считается, что его нейролептические свойства опосредованы антагонизмом дофаминовых и серотониновых рецепторов. Дополнительное преимущество оланзапина заключено в нормализации работы пораженных областей головного мозга (связанных с когнитивными функциями и эмоциональной обработкой) и обеспечении более длительного времени до прекращения лечения, что способствует лучшей приверженности пациентов, особенно хронически больных [3] [4].
Оланзапин, в сравнении с другими распространенными атипичными антипсихотиками, характеризуется низким риском экстрапирамидальных побочных эффектов, включая тардивную дискинезию: ввиду того, что он проявляет усиленную аффинность к серотониновому рецептору 5-HT2A относительно дофаминового рецептора D2.
Частым нежелательным явлением (НЯ) всех атипичных нейролептиков — и в особенности оланзапина [5] — являются метаболические нарушения, выражающиеся существенной прибавкой массы тела с сопутствующим ростом риска развития гипергликемии и сахарного диабета 2-го типа (СД2). Увеличение веса связано, как предполагается, с антагонизмом гистаминового рецептора H1, вызывающим седацию, и антагонизмом 5-HT2C и D2, приводящим к стимулированию аппетита [6]. Кроме того, оланзапин проявляет сильный антагонизм мускаринового рецептора M3, что, возможно, объясняет его диабетогенный эффект [7].
Самидорфан, структурно похожий на налтрексон (naltrexone), работает главным образом как антагонист μ-опиоидного рецептора, попутно проявляя частичный агонизм в отношении κ- and δ-опиоидных рецепторов [8] [9] [10]. Антагонизм опиоидных рецепторов опосредует ингибирование мезолимбической системы вознаграждения и, согласно исследованиям на грызунах, способствует смягчению индуцированных лекарствами роста массы тела и/или метаболических расстройств [11] [12] [13].
ИНТЕРЕСНЫЙ ФАКТ
Уместно напомнить, что оланзапин, дебютировавший в сентябре 1996 года под брендом «Зипрекса» (Zyprexa), породил сонм судебных исков к оригинатору в лице «Илай Лилли» (Eli Lilly), которая зарабатывала на нем многие миллиарды долларов. К примеру, в пятилетний период 2003–2007 гг. продажи оланзапина составили $22 млрд, или треть от общего дохода, а с момента своего появления до 2020 года включительно «Зипрекса» заработал свыше $60 млрд.
По мнению истцов, оланзапин является причиной развития метаболических расстройств, гипергликемии, ожирения, СД2 и других заболеваний, а поскольку фармпредприятие этот вопрос обходило стороной и не уделяло должное внимание информированию о подобных рисках, оно должно быть наказано самым жесточайшим образом. Так и произошло: в 2006–2007 гг. «Илай Лилли» заплатила свыше $1,2 млрд в рамках урегулирования приблизительно 28,5 тыс. судебных претензий [1] [2].
Согласно всплывшим внутренним корпоративным документам «Илай Лилли», фармпредприятие намеренно и осознанно преуменьшало значимость нежелательных побочных эффектов оланзапина и считало рост веса пациентов, зачастую приводящий к ожирению, главной угрозой для реализации «Зипрексы». В ответ на публичные претензии «Илай Лилли», как и всякий защитник высокоприбыльного бизнеса, продолжала напропалую лгать, заявляя о предвзятости и избирательности искомых документов и настойчиво подчеркивая научно подтвержденную безопасность своего препарата [3] [4].
В январе 2009 года «Илай Лилли» была признана виновной в мошеннической реализации оланзапина не по назначению. Согласно обвинительным документам, с сентября 1999 года по как минимум конец 2005 года «Зипрекса» преступным образом продвигался (особенно среди пожилых людей) как лекарство против ажитации, агрессии, враждебности, депрессии, генерализованного расстройства сна, а также деменции, в том числе вызванной болезнью Альцгеймера [5] [6].
Руководство «Илай Лилли» создавало маркетинговые материалы, рекламирующие применение «Зипрексы» не по показаниям (офф-лейбл), а по симптомам, обучало своих торговых представителей игнорировать закон, инструктировало сотрудников всячески и нелегально поощрять врачей выписывать рецепты на оланзапин. Для этого были потрачены значительные финансовые ресурсы, в том числе на программы непрерывного медицинского образования, «затуманивающие» и «дезинформирующие», в целях улучшения финансовых результатов компании.
Сумма штрафных санкций составила $1,415 млрд, из которых $515 млн пришлись на взыскания по уголовному делу и стали самым на тот момент крупным наказанием в истории здравоохранения, а $800 млн относились к гражданскому урегулированию.
Подробности этого громкого дела, похожего на причудливый триллер, изложены в книге «Досье „Зипрексы“» (The Zyprexa Papers), написанной адвокатом Джимом Готтштейном (Jim Gottstein), защищавшим людей с психическими заболеваниями. Книга пригодится всем тем, кто хотел бы заглянуть в бездну корпоративной жадности и чудовищной коррупции, ознакомиться с нескончаемыми бессовестными коммерческими практиками, прочувствовать мощь властвования «Большой фармы» над здоровьем человека [7].
КЛИНИЧЕСКИЕ ПОДРОБНОСТИ
Поскольку основным лекарственным компонентом «Либолви» является оланзапин, который давно и успешно применяется в терапии шизофрении и биполярного расстройства I типа, для регуляторного одобрения нового препарата авторства «Алкермес» было необходимо подтвердить, что его клиническая эффективность не уступает оланзапину.
Клиническое исследование ENLIGHTEN-1 (NCT02634346) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, с активным контролем, многоцентровое, международное) привлекло взрослых пациентов (n=352) с шизофренией.
Среди основных требований к участникам: общий балл по шкале позитивных и негативных синдромов (PANSS) ≥ 80 (хотя бы 3 подбалла позитивной шкалы должны были быть ≥ 4) и балл ≥ 4 согласно общему клиническому впечатлению о тяжести депрессии (CGI-S).
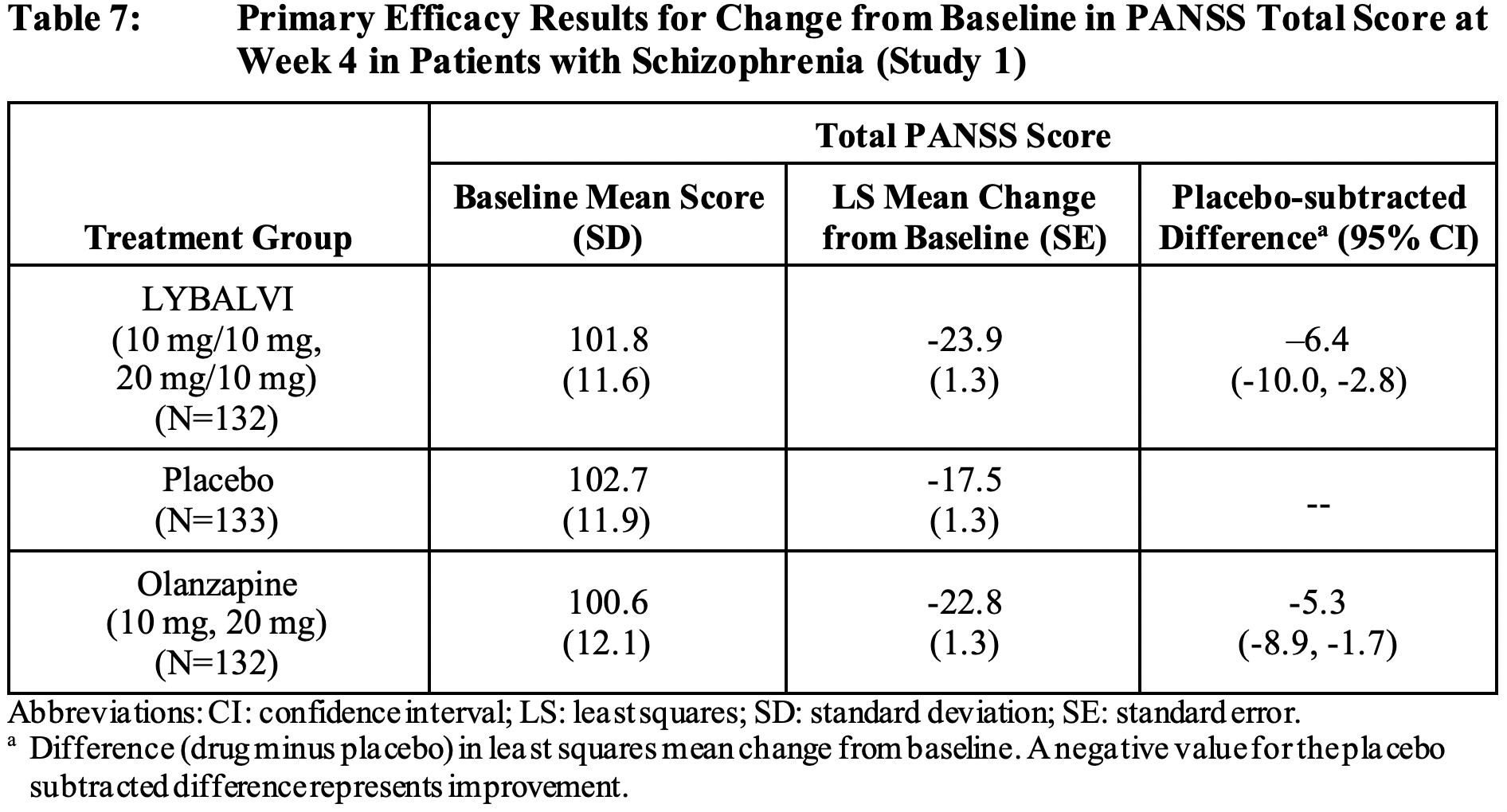
Первичная конечная точка была установлена изменением общего балла PANSS по прошествии 4 недель лечения, в ходе которого участники ежедневно перорально получали «Либолви», оланзапин или плацебо.
Группа «Либолви» продемонстрировала усредненное изменение общего балла PANSS относительно плацебо на уровне −6,4 (95% ДИ [здесь и далее]: −10,0, −2,8; p<0,001), группа оланзапина — в пределах −5,3 (−8,9, −1,7; p=0,004). Таким образом, терапевтическая эффективность «Либолви» оказалась не хуже оланзапина [1].
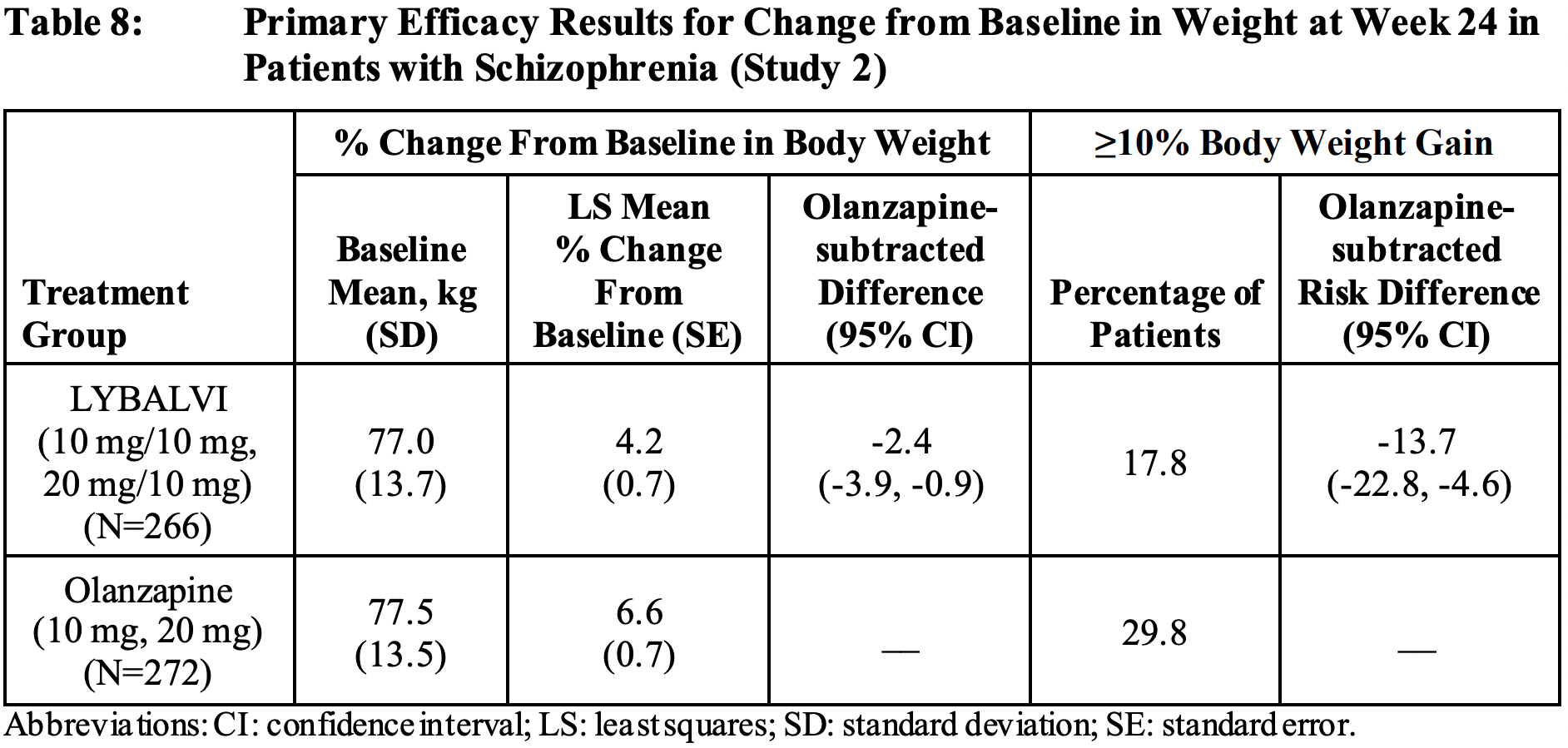
Клиническое исследование ENLIGHTEN-2 (NCT02694328) фазы III (рандомизированное, двойное слепое, с активным контролем, многоцентровое) поставило своей задачей сравнить изменение веса у взрослых пациентов с шизофренией (общий балл PANSS 50–90, балл CGI-S score ≤ 4), проходивших терапию при помощи «Либолви» или оланзапина.
По прошествии 24 недель лечения выяснилось, что в группе «Либолви» усредненная прибавка массы тела составила 4,2% от исходной — против 6,6% в группе оланзапина (p=0,003). При этом 18% испытуемых в группе экспериментального лечения столкнулись с ростом веса на ≥ 10% — против 30% в группе контроля: отношение шансов (odds ratio, OR) 0,50 (0,31–0,80) [2].
Клиническое исследование ENLIGHTEN-2-EXT (NCT02873208) фазы III (нерандомизированное, открытое, многоцентровое) изучило долгосрочные эффекты «Либолви» среди взрослых пациентов с шизофренией, которые закончили участие в ENLIGHTEN-2.
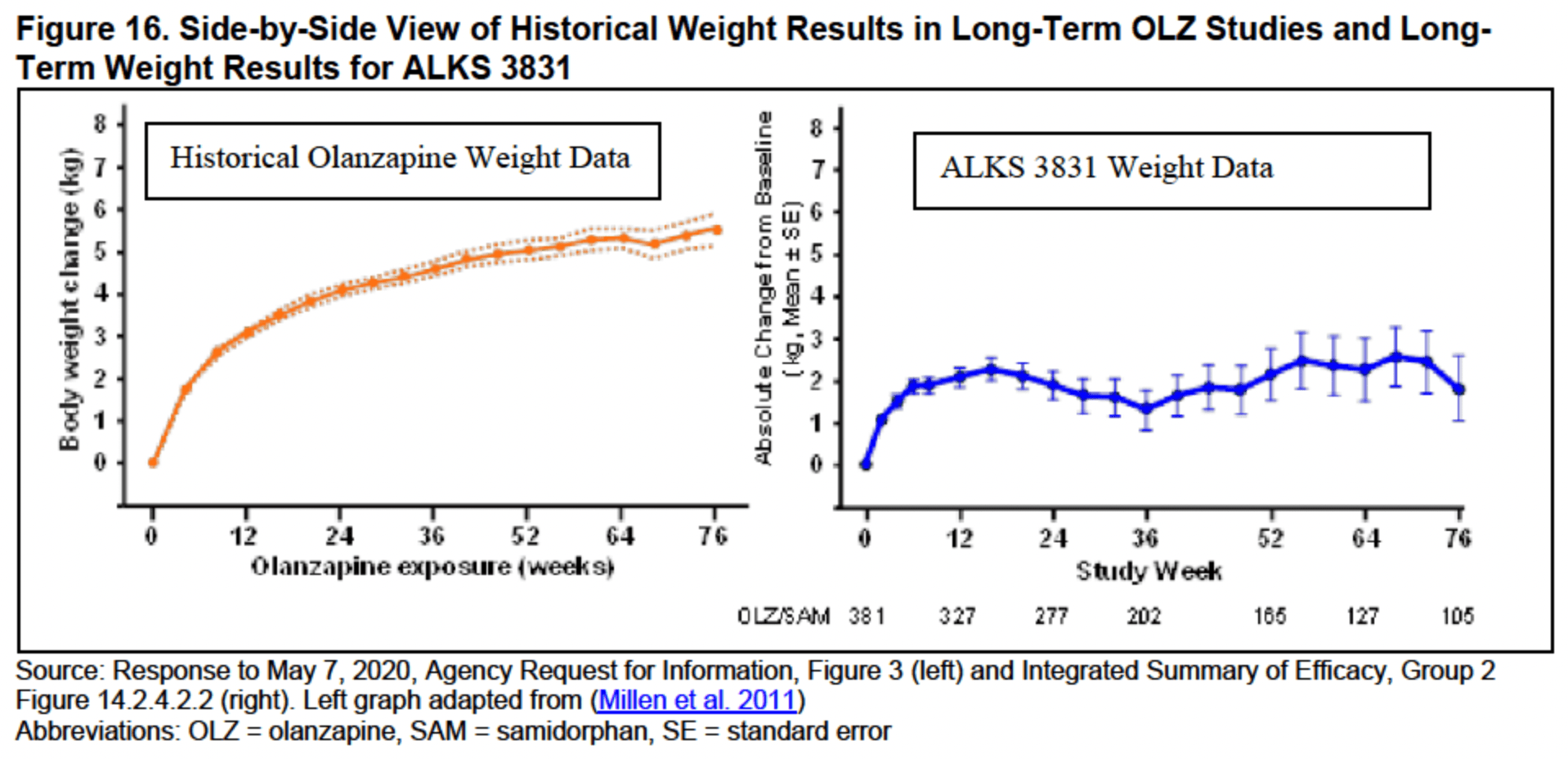
По истечении 52 недель терапии было продемонстрировано, что длительное применение «Либолви» отражается фактической стабилизацией прибавки массы тела. Так, после завершения ENLIGHTEN-2 усредненный рост веса оказался равным 5,6% (от исходного [здесь и далее]), затем, после 12 недель терапии в рамках ENLIGHTEN-2-EXT, этот показатель составил 6,4%, после 28 недель — 5,4%, и, наконец, после 52 недель — 4,5% [3].
Длительное использование сочетания оланзапина с самидорфаном на протяжении 2 и 4 лет кряду показало, что пациенты (n=232 и n=109) оставались симптоматически стабильными, тогда как их масса тела всё же увеличивалась, но совсем незначительно: за указанное время прибавка составила в среднем 0,84 и 2,65 кг — с исходных 77,4 кг. Окружность талии также изменилась: с изначальных 90 см она уменьшилась на 0,6 см, а затем выросла на 1,4 см. Уровни метаболических показателей, таких как холестерин, триглицериды, гликированный гемоглобин, глюкозы в крови, изменились несущественным образом [4].










Терапевтическая эффективность «Либолви» в лечении биполярного расстройства I типа отдельно не проверялась, потому что хватает обширных данных соответствующих клинических испытаний оланзапина.
ЧТО ДАЛЬШЕ
«Алкермес» надеется расширить популяцию пациентов, пригодных для назначения «Либолви», и для этого проводит клиническое исследование ENLIGHTEN-Youth (NCT05303064) фазы III в педиатрической возрастной группе с шизофренией (13–17 лет) или биполярным расстройством I типа (10–17 лет).
ЭКСПЕРТНЫЕ КОММЕНТАРИИ
Два метаанализа выяснили, что оланзапин является одним из наиболее эффективных нейролептиков для неотложного и поддерживающего лечения шизофрении. Однако применение именно оланзапина сильнее всех других антипсихотиков сказывается значительным увеличением веса [1] [2].
Оланзапин также подходит для терапии маниакальных или смешанных эпизодов, ассоциированных с биполярным расстройством I типа [3] [4]. Но опять же, его назначение ассоциировано с повышенным риском существенного роста массы тела и метаболических нарушений, включая развитие СД2 и дислипидемии [2] [5] [6] [7] [8].
Ввиду указанных особенностей отмечается снижение врачебного и пациентского интереса к оланзапину [9].
Метаанализ клинических испытаний, проверивших 15 различных фармакологических интервенций для сдерживания вызванного атипичными антипсихотиками роста массы тела, установил, что метформин (metformin), фенфлурамин (fenfluramine), сибутрамин (sibutramine), топирамат (topiramate) и ребоксетин (reboxetine) действительно обеспечивают указанный благоприятный эффект, однако в очень скромных пределах, что не позволяет их рекомендовать для применения на фоне лечения психиатрических заболеваний [10].
Согласно систематическому обзору и метаанализу шести рандомизированных клинических испытаний сочетания оланзапина с самидорфаном, охвативших 1655 пациентов, эффективность «Либолви» такая же, как у оланзапина. Лекарственная комбинация реже приводит к набору веса, однако сопровождается более частыми нежелательными явлениями, такими как сонливость, сухость во рту, головная боль [11].
Добавление самидорфана к оланзапину действительно эффективно сдерживает прибавку массы тела, но для того чтобы «Либолви» смог легко вытеснить оланзапин, ему необходимо стать более доступным по цене. Тем более непосредственно оланзапин повсеместно доступен в виде недорогих генерических копий. Пациентам будут назначать «Либолви», скорее всего, после нескольких курсов других антипсихотиков, когда больные уже «устанут» от избыточного веса.
Для справки: среди пероральных антипсихотиков доля оланзапина в лечении шизофрении составляет 21%, биполярного расстройства I типа — 12%.
Кроме того, существуют определенные опасения на предмет безопасности «Либолви». Дело в том, что самидорфан, будучи опиоидным антагонистом, может вызвать синдром отмены у пациентов, физически зависимых от опиоидов (в популяции психиатрических больных распространенность злоупотребления опиоидами относительно велика), или привести к передозировке опиоидов среди тех, кто попытается преодолеть блокирующий опиоиды эффект самидорфана. Именно поэтому в инструкцию по медицинскому применению «Либолви» включены соответствующие предупреждения [12].
Как бы то ни было, весьма примечательно, что даже длительное применение «Либолви» характеризуется стабилизацией роста массы тела, ведь хроническое назначение оланзапина во многих случаях сопровождается постоянным увеличением веса, зачастую приводящим к многочисленным метаболическим нарушениям.
БИЗНЕС
Консенсусные отраслевые прогнозы будущих продаж «Либолви», сделанные до его выхода на рынок, сводились к $380 млн к 2026 году.
Фактические успехи «Алкермес» в реализации «Либолви», который поступил в продажу в октябре 2021 года, получились следующими: $8,2 млн, $96,0 млн, $191,9 млн — соответственно в 2021, 2022 и 2023 гг. За первую половину 2024 года препарат заработал $128,4 млн, за весь 2024-й он, как ожидается, принесет $275–295 млн.
«Либолви» защищен 15 патентами, два из которых уже истекли. С конца мая 2025 года интеллектуальная собственность «Алкермес» на это комбинированный лекарственный препарат будет открыта для оспаривания.