ЧТО ПРОИЗОШЛО
Фармакологические усилия борьбы с болезнью Паркинсона путем избавления от нейротоксичного альфа-синуклеина выглядят не особо впечатляющими с точки зрения терапевтической эффективности — тем не менее игроки фармотрасли не сдаются.
СУТЬ ВОПРОСА
Болезнью Паркинсона, вторым после болезни Альцгеймера самым распространенным нейродегенеративным возрастным заболеванием, страдают свыше 10 млн человек в мире. К 2040 году число больных, как ожидается, достигнет 17 млн человек, приобретя форму пандемии [1] . Несмотря на многочисленные исследовательские усилия, болезнь Паркинсона по-прежнему остается неизлечимой [2].
Отличительными патологическими особенностями болезни Паркинсона являются дегенерация дофаминергических нейронов и отложения телец Леви, состоящих в основном из нерастворимых агрегатов, образованных неправильно свернутым альфа-синуклеином (синуклеопатия) — небольшим белком, состоящий из 140 аминокислот.
В последние годы гипотеза агрегации альфа-синуклеина привлекает большое внимание. Она постулирует, что в патологических условиях альфа-синуклеин подвергается мисфолдингу (неправильному сворачиванию), что приводит к его конформационным изменениям, вызывающим аномальную агрегацию. В ходе этого процесса образуются различные виды агрегатов альфа-синуклеина, включая олигомеры, протофибриллы и фибриллы, все из которых цитотоксичны для нейронов и способствуют их гибели. Особенно губительны промежуточные олигомеры и протофибриллы, причем растворимые протофибриллы обладают большей нейротоксичностью, чем нерастворимые зрелые фибриллы [3] [4].
Токсичные промежуточные продукты ответственны за запуск каскада событий, включая дисфункцию митохондрий, нейровоспаление, деформацию нейронов и ферроптоз, которые тесно связаны с патогенезом болезни Паркинсона. Они нарушают синаптическую передачу, функции органелл и целостность цитоскелета, структуру мембран и гематоэнцефалического барьера (ГЭБ) [5] [6].
Если говорить о митохондриях, которые являются основным источником реактивных форм кислорода (ROS) в клетках, то они особенно уязвимы для агрегатов альфа-синуклеина. Последние задействуют механизмы связывания с комплексами митохондриальной дыхательной цепи, взаимодействия с митохондриальными порами переходной проницаемости, вмешательства в импорт митохондриальных белков, нарушения контроля качества митохондрий [7].
Агрегация альфа-синуклеина нарушает работу аутофагического лизосомального пути (ALP) и убиквитин-протеасомной системы (UPS) — двух основных механизмов деградации неправильно свернутых и агрегированных белков, — что отражается изменениями внутриклеточного транспорта и снижением скорости клиренса поврежденных белков [8] [9].
В физиологических условиях микроглия и астроциты функционируют как соответственно ключевые иммунные и опорные клетки центральной нервной системы (ЦНС). Однако в присутствии патологического альфа-синуклеина пролиферация микроглии стимулируется такими механизмами, как активация толл-подобных рецепторов (TLR) и сигнальных путей p38/ATF2 и ядерного фактора κB (NF-κB). Всё это результирует выработкой различных факторов воспаления и ROS, способствуя дисфункции и гибели дофаминергических нейронов [10]. Альфа-синуклеиновые агрегаты активируют микроглию, которая дифференцируется в провоспалительный фенотип (фенотип M1) и вырабатывает провоспалительные факторы, хемокины и нейротоксические факторы, которые побуждают астроциты трансформироваться в нейротоксический фенотип (фенотип A1) [11], еще больше усиливающий активацию микроглии [12].
Альфа-синуклеиновые агрегаты распространяются по организму в первую очередь «прионоподобным» образом. Они также могут распространяться через туннелирующие нанотрубки (нанотуннели между клетками) [13], экзосомы [14] и посредством иных механизмов, что приводит к повсеместному отложению этих патологических белков по всему головному мозгу, особенно в неокортексе, гиппокампе, стриатуме, таламусе и мозжечке [6]. Аномальная агрегация альфа-синуклеина не ограничивается мозгом: она наблюдается в спинном мозге и периферической нервной системе, включая симпатические ганглии, блуждающий нерв, сердечные нервы и желудочно-кишечную систему [15].
Согласно гипотезе «кишечник — мозг», при болезни Паркинсона патологические процессы зарождаются в кишечнике и впоследствии распространяться на головной мозг [16]. Альфа-синуклеин вызывает изменения в составе микробиоты кишечника и кишечное воспаление, что приводит к дисфункции иммунной системы кишечника, энтеральной нервной системы и кишечного барьера. Активация глиальных клеток кишечника, повышенная кишечная проницаемость и окислительный стресс повышают уровень экспрессии альфа-синуклеина в кишечнике, что отражается мисфолдингом и аномальной агрегацией этого белка. Хроническое периферическое воспаление нарушает целостность ГЭБ, способствуя переносу альфа-синуклеина из кишечника в ЦНС [17] [18].

Эффект «Оземпика». Лечение болезни Паркинсона препаратами от диабета и ожирения
GLP1R-агонисты вроде ликсисенатида, эксенатида или семаглутида сдерживают прогрессирование моторных нарушений при болезни Паркинсона.
ПРАСИНЕЗУМАБ: PROTHENA / ROCHE
Ирландская «Проутина» (Prothena) совместно с «Рош» (Roche) доводит до ума гуманизированное моноклональное антитело прасинезумаб (prasinezumab, RG7935, PRX002, NEOD002) против агрегированного альфа-синуклеина. Но результаты пока не впечатляют.
Прасинезумаб, оригинатором которого является, «Неотоуп байосайенсиз» (Neotope Biosciences), связывается с человеческим агрегированным альфа-синуклеином с высоким сродством и авидностью. На мышиных моделях болезни Паркинсона и деменции с тельцами Леви прасинезумаб снижал уровень C-концевой усеченной формы альфа-синуклеина, которая считается нейротоксичной, а также сдерживал распространение альфа-синуклеина от клетки к клетке [1] [2] [3].
Клиническое исследование PASADENA (NCT03100149) фазы II, организованное среди пациентов (n=316) с недавно диагностированной болезнью Паркинсона (длительность заболевания не дольше 2 лет) и не придерживающихся заместительной дофаминой терапии, не смогло обеспечить выход к первичной конечной точке, заявленной улучшением общего балла по унифицированной рейтинговой шкале оценки болезни Паркинсона Международного общества изучения двигательных расстройств (MDS-UPDRS), которая оценивает тяжесть и прогрессирование этого заболевания [4] [5].
Однако затем выяснилось, что улучшения всё же есть, и они связаны с моторными функциями: годичный курс терапии из ежемесячных вливаний прасинезумаба привел к 35-процентному относительно плацебо сдерживанию прогрессирования моторных нарушений, такие как замедленность движений (брадикинезия), тремор, ригидность, нестабильность походки — согласно изменению балла части III шкалы MDS-UPDRS [6] [7]. При этом благотворный эффект замедления ухудшений, оказавшийся справедливым главным образом среди лиц с быстрым прогрессированием болезни Паркинсона, продолжал усиливаться в ходе продолжения лечения сроком максимум 4 года [8].
В мае 2021 года было запущено клиническое исследование PADOVA (NCT04777331) фазы IIb, проверяющее, насколько хорошо прасинезумаб сдерживает процесс ухудшения моторных функций у пациентов (n=586) с болезнью Паркинсона в более запущенной, чем в PASADENA, форме. Результаты будут раскрыты к концу 2024 года.
- В середине декабря 2024 года стало известно о провале PADOVA: прасинезумаб не смог статистически значимым образом опередить плацебо, хотя численно (номинально) превзошел, на 16% отсрочив время до подтвержденного прогрессирования ухудшения двигательных функций — отношение риска (hazard ratio, HR) 0,84 (95% ДИ [здесь и далее]: 0,69–1,01; p=0,0657). В популяции пациентов, получавших терапию леводопой (75% испытуемых), эффект был более выраженным: HR 0,79 (0,63–0,99; p=0,0431). Отмечены устойчивые положительные тенденции по множеству вторичных и эксплоративных конечных точек [9] [10].
Согласно анализу данных, скорректированных по ряду ковариат (включая возраст, пол, стадию по Хён и Яру, применение фоновых медикаментов), терапевтический эффект прасинезумаба оказался номинально значимым: соответственно HR 0,81 (0,67–0,98; p=0,0334) и HR 0,76 (0,61–0,95; p=0,0175).
МИНЗАСОЛМИН И UCB7853: UCB / NOVARTIS
В декабре 2021 года бельгийская «ЮСиБи» (UCB) договорились с «Новартис» (Novartis) о совместной разработке и коммерциализации двух лекарственных активов, предназначенных для лечения болезни Паркинсона [1].
По условиям соглашения,«ЮСиБи» получит от «Новартис» авансом $150 млн и последующие выплаты на сумму до $1,5 млрд долларов по мере прохождения определенных этапов развития экспериментальных проектов. В случае коммерциализации готовых лекарств доходы будут делиться территориально: «ЮСиБи» займется их реализацией в Европе и Японии, «Новартис» — в США и других странах.
Партнерство касается двух препаратов-кандидатов, нацеленных на альфа-синуклеин.
Минзасолмин (minzasolmin, UCB0599,NPT200-11, DLX-313), который «ЮСиБи» в 2014 году лицензировала у «Ньюропор терапис» (Neuropore Therapies), ингибирует внутриклеточную агрегацию альфа-синуклеина. Низкомолекулярный минзасолмин, будучи циклической пептидомиметической молекулой, является соединением второго поколения, оптимизированным для пероральной биодоступности и прохождения через гематоэнцефалический барьер.
Минзасолмин, который взаимодействует с C-концевым доменом альфа-синуклеина и предотвращает его связывание с мембранами с дальнейшей олигомеризацией в них, in vitro сдерживает агрегацию альфа-синуклеина, а на трансгенных мышиных моделях нормализует нейронные и воспалительные маркеры, устраняет моторный дефицит, ослабляет кортикальную альфа-синуклеиновую патологию и астроглиоз, нормализует уровень стриарного дофаминового транспортера [2] [3].
В декабре 2020 года «ЮСиБи» приступила к 18-месячному клиническому исследованию ORCHESTRA (NCT04658186) фазы IIa (рандомизированному, двойному слепому, плацебо-контролируемому, многоцентровому, международному), проверяющему терапевтическую эффективность минзасолмина среди пациентов (n=496) с болезнью Паркинсона на ранней стадии (стадия паркинсонизма ≤ 2,5 по Хён и Яру, длительность заболевания не дольше 2 лет). Результаты должны быть собраны ближе к концу 2024 года.
- В середине декабря 2024 года стало известно о провале ORCHESTRA: минзасолмин не смог обеспечить выход ни к первичной конечной точке эффективности лечения болезни Паркинсона (изменение суммарного балла частей I–III шкалы MDS-UPDRS), ни к вторичным (изменения баллов отдельных частей этой шкалы) — экспериментальное лечение не замедлило прогрессирование заболевания [4].
Продолжается клиническое испытание NCT05543252 фазы II, изучающее долгосрочные безопасность, переносимость и эффективность минзасолмина при впервые поставленном диагнозе болезни Паркинсона пациентам (n=428) из других исследований этого экспериментального препарата. Оно завершится в 2027 году.
- Отсутствие доказательств клинической пользы минзасолмина привело к прекращению NCT05543252.
UCB7853 — моноклональное антитело против альфа-синуклеина, подавляющее его внеклеточное распространение.
В декабре 2020 года было запущено клиническое исследование NCT04651153 фазы I, оценивающее различные внутривенные дозы UCB7853 с позиций безопасности, переносимости и фармакокинетики — среди здоровых добровольцев и пациентов с болезнью Паркинсона на легко-умеренной стадии. Испытание завершено, дальнейших шагов по развитию проекта пока не предпринималось.
- В середине декабря 2024 года, после клинической неудачи минзасолмина, «ЮСиБи» подтвердила свою приверженность продолжению разработки UCB7853 [4].
В свое время утверждалось, что UCB0599 и UCB7853 органично дополняют друг друга в задаче замедления прогрессирования болезни Паркинсона: первый препарат показан на ранних ее стадиях, второй подходит при более запущенных состояниях.

Тавападон: новое лечение болезни Паркинсона
Дофаминомиметик тавападон предназначен для улучшения моторных функций при паркинсонизме без обременяющих побочных эффектов.
ЭКСИДАВНЕМАБ: BIOARCTIC / ABBVIE
В руках «ЭббВи» (AbbVie) было гуманизированное моноклональное антитело эксидавнемаб (exidavnemab, ABBV-0805, BAN0805), в декабре 2018 года лицензированное у шведской «Байоарктик» (BioArctic) и связывающее олигомерные и протофибриллярные формы альфа-синуклеина различных конформаций с пикомолярной аффинностью [1] [2].
Эксидавнемаб характеризуется очень высокой (100 тыс. раз) селективностью связывания агрегированного альфа-синуклеина относительно его мономерных форм. Для сравнения: сродство прасинезумаба (prasinezumab, RG7935, PRX002) и цинпанемаба (cinpanemab, BIIB054), за которыми стоят «Рош» (Roche) / «Проутина» (Prothena) и «Байоджен» (Biogen) / «Ньюримьюн» (Neurimmune), к агрегированному альфа-синуклеину соответственно в 400 и 800 раз выше, чем к мономерному.
Учитывая высокий уровень физиологических мономеров альфа-синуклеина в крови, важно минимизировать его связывание, во-первых, во избежание периферической секвестрации антитела в плазме, чтобы его большее количество достигло своих мишеней в головном мозге, и, во-вторых, для улучшенного профиля безопасности и сниженной терапевтической дозы.
Согласно клинической проверке среди здоровых добровольцев (n=95), эксидавнемаб, назначаемый однократно внутривенно по 300–6000 мг или подкожно по 300 мг, сохраняет свою активность продолжительное время: период полувыведения составляет приблизительно 30 дней. Установлено дозозависимое снижение плазматической концентрации свободного альфа-синуклеина. Каких-либо проблем с безопасностью не выявлено [3].
Будущее эксидавнемаба казалось туманным, поскольку в июле 2020 года «ЭббВи» по стратегическим причинам остановила соответствующее клиническое испытание NCT04127695 фазы I. Впоследствии компания вышла из партнерства с «Байоарктик», которая стала самостоятельно развивать этот препарат-кандидат [4].
В ноябре 2024 года было организовано клиническое исследование EXIST (NCT06671938) фазы IIa среди пациентов (n=24) с легко-умеренной болезнью Паркинсона, следующих стабильным курсом симптоматической терапии. Завершение запланировано на 2026 год. По результатам «Байоарктик» примет окончательное решение, что делать с эксидавнемабом: сворачивать проект либо продолжать им заниматься в целях лечения болезни Паркинсона, деменции болезни Паркинсона, деменции с тельцами Леви или множественной системной атрофии.
PD01A: AC IMMUNE
Несмотря на скудные успехи игроков «Большой фармы», швейцарская «ЭйСи имьюн» (AC Immune) верит в разумность гипотезы альфа-синуклеина: для этого в июле 2021 года у австрийской «Аффирис» (AFFiRiS) была куплена PD01A — активная вакцина против альфа-синуклеина [1].
Иммуноген в составе PD01A представляет собой пептид из восьми аминокислот (PD01), который имитирует эпитоп в C-концевой области человеческого альфа-синуклеина, но с другой аминокислотной последовательностью. Пептид конъюгирован с белком-носителем гемоцианином лимфы улитки (KLH) и адсорбирован на адъювантном гидроксиде алюминия. Вакцина PD01A разработана таким образом, чтобы стимулировать В-клеточный антительный ответ, но обходить аутореактивную мобилизацию Т-клеток, которая может вызвать ненужные нейровоспалительные реакции.
Активная иммунизация при помощи PD01A генерирует антитела, которые избирательно распознают агрегаты альфа-синуклеина с гораздо меньшим сродством к его мономерным формам и без реактивности к бета-синуклеину. Белок-носитель обеспечивает необходимые эпитопы Т-хелперов для индукции длительного и усиленного ответа антител, тогда как антигенный компонент (PD01) действует исключительно как В-клеточный эпитоп и отвечает за специфичность гуморального иммунного ответа [2].
В июле 2023 года «ЭйСи» запустила клиническое испытание VacSYn (NCT06015841) фазы II, которое изучает экспериментальную вакцину ACI-7104.056, представляющую собой PD01 в оптимизированной рецептуре, среди пациентов (n=150) с болезнью Паркинсона на начальной стадии. К концу 2024 года будет предоставлен первый промежуточный отчет о безопасности и иммуногенности вакцины. Срок окончания исследования — начало 2028 года.
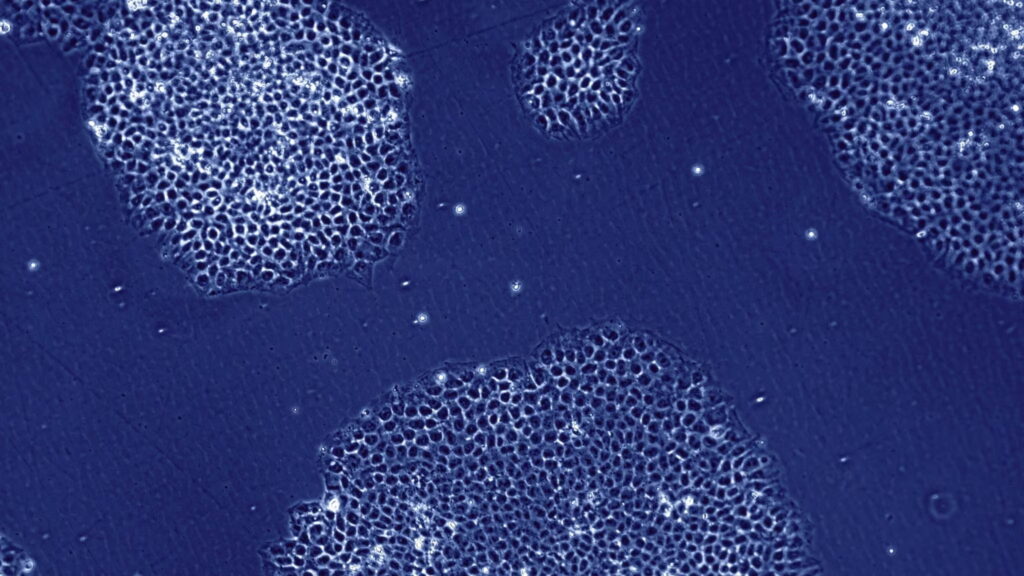
Бемданепроцел: клеточная терапия болезни Паркинсона
Однократная имплантация предшественников дофаминергических нейронов в головной мозг облегчит симптомы нейродегенеративного заболевания.
ЦИНПАНЕМАБ: NEURIMMUNE / BIOGEN
Ничего не получилось у «Байоджен» (Biogen) с моноклональным антителом цинпанемаб (cinpanemab, BIIB054), лицензированным у швейцарской «Ньюримьюн» (Neurimmune) и таргетированным против агрегатов альфа-синуклеина. Хотя в отрасли считалось, что этот препарат наиболее совершенный с технической точки зрения. В клиническом испытании SPARK (NCT03318523) фазы II цинпанемаб не обеспечил каких-либо значимых улучшений по шкале MDS-UPDRS. В феврале 2021 года дальнейшая разработка цинпанемаба была прекращена [1].
ABL301: ABL BIO / SANOFI
В середине января 2022 года «Санофи» (Sanofi) приобрела у корейской «Эй-би-эл байо» (ABL Bio) мировую лицензию на экспериментальный препарат ABL301 (SAR446159), предназначенный для лечения болезни Паркинсона [1].
Сделка предполагает выплату $75 млн авансом и последующей суммы до $985 млн по мере развития проекта, а также роялти от продаж готового лекарства.
ABL301 представляет собой биспецифическое моноклональное антитело, таргетированное на альфа-синуклеин и рецептор инсулиноподобного фактора роста 1 (IGF1R) [2] [3].
ABL301 с высокой аффинностью распознаёт патологические агрегаты альфа-синуклеина, обходя стороной его мономерные формы. Нацеливание на IGF1R, сделанное в рамках технологической платформы Grabody-B, позволяет ABL301 без проблем миновать гематоэнцефалический барьер (ГЭБ). Поскольку IGF1R высоко и относительно специфично экспрессирует на эндотелиальных клетках головного мозга, ABL301 проникает в мозг посредством рецептор-опосредованного трансцитоза (RMT).
Как утверждает «Эй-би-эл», ее ABL301 характеризуется рядом выгодных преимуществ перед другими моноклональными антителами, которые разрабатывают игроки фармотрасли. Во-первых, биологические лекарственные препараты конкурентов весьма плохо проникают через ГЭБ: в головном мозге обнаруживается приблизительно 0,1–0,2% таких антител.
Во-вторых, биопрепараты соперников фактически без особого разбора связывают агрегированные и мономерные формы альфа-синуклеина, хотя именно первые вовлечены в патофизиологические каскады при болезни Паркинсона.
В-третьих, ABL301 располагает двойным механизмом действия: содействие фагоцитозу внеклеточного альфа-синуклеина микроглиальными клетками и подавление прионоподобного распространения альфа-синуклеина от клетки к клетке. Антитела конкурентов в основном осуществляют только второе.
Продолжается клиническое испытание NCT05756920 фазы I среди здоровых добровольцев (n=86). Его завершение намечено к началу 2025 года.
БУНТАНЕТАП: ANNOVIS BIO
Интересным видится подход «Анновис байо» (Annovis Bio): ее низкомолекулярный препарат-кандидат бунтанетап (buntanetap, ANVS401), также известный как посифен (posiphen), нацелен сразу на три нейротоксичных белка — бета-амилоид, альфа-синуклеин и тау-белок. Все они нарушают аксональный транспорт нейромедиаторов и нейротрофических факторов и замедляют синаптическую передачу, тем самым ухудшая нервную деятельность в целом. Подобные нарушения приводят к активации иммунной системы, которая атакует нервные клетки, что приводит к нейровоспалению, дегенерации и смерти нервных клеток. Итогом становится ухудшение когнитивной и моторной деятельности.
Бунтанетап: прорыв в лечении болезни Альцгеймера и болезни Паркинсона
Бунтанетап действует сразу на три нейротоксичных белка, ответственных за нейродегенеративные нарушения, — бета-амилоид, альфа-синуклеин и тау-белок.
ЭМРУСОЛМИН: MODAG / TEVA
Немецкая «Модаг» (Modag) обкатывает низкомолекулярный эмрусолмин (emrusolmin, anle138b, TEV-56286), связывающий олигомерный альфа-синуклеин.
Клиническое исследование NCT04208152 фазы I протестировано эмрусолмин среди взрослых добровольцев (n=68), установив его приемлемые безопасность и переносимость [1].
Клиническое испытание NCT04685265 фазы Ib проверило назначение различных доз эмрусолмина пациентам с легко-умеренной болезнью Паркинсона. Исследование, завершившееся в конце 2022 года, результатов так и не предоставило.
В конце октября 2021 года к проекту эмрусолмина подключилась «Тева фармасьютикал индастриз» (Teva Pharmaceutical Industries), пожелавшая обзавестись мировыми правами на этот препарат-кандидат [2]. Партнерство также касается sery433 — пролекарства эмрусолмина, разработанного с прицелом повышения его биодоступности [3].
«Тева» осуществляет 56-недельное клиническое испытание TOPAS-MSA (NCT06568237) фазы II, изучающее эмрусолмин в лечении множественной системной атрофии. Результаты будут собраны к середине 2027 года.
Пероральный низкомолекулярный эмрусолмин, эффективно преодолевающий гематоэнцефалический барьер (ГЭБ), специфически и с наномолярной аффинностью связывает токсичные олигомерные структуры внутриклеточного альфа-синуклеина, что приводит к их растворению и предотвращению образования новых олигомеров.
Поскольку эмрусолмин разрушает преамилоидные олигомеры и нарушает рост фибрилл, это приводит, в сочетании с механизмами клеточного клиренса, к уменьшению количества отложенных амилоидных фибрилл. Эмрусолмин не является разрушителем фибрилл, что важно, так как их фрагментация усиливает прионоподобное распространение токсичных белков и прогрессирование болезни за счет образования большего количества частиц, способных привлекать мономеры путем неправильного фолдинга.
Эмрусолмин, будучи дифенилпиразольным соединением, подавляет образование олигомеров альфа-синуклеина и прионного белка. На различных мышиных моделях синуклеопатий и болезни Паркинсона эмрусолмин препятствовал накоплению олигомеров и дегенерации нейронов [4], улучшил функцию дофаминовых нейронов и моторные функции [5], сдержал прогрессирование заболевания, причем даже после клинической манифестации болезни Паркинсона [6].
Утверждается также, что поскольку патологические олигомеры при нейродегенеративных заболеваниях имеют общие структурные особенности, хотя основной белковый компонент специфичен для каждой болезни, а эмрусолмин модулирует образование олигомеров путем воздействия на структурно-зависимые эпитопы, эта молекула, не исключено, может найти себя в лечении различных патологий, связанных с агрегацией белков [4].
На мышиных моделях множественной системной атрофии эмрусолмин снизил количество олигомеров альфа-синуклеина, сохранил дофаминергические нейроны и улучшил ходьбу [7], сдержал нейродегенерацию в черном веществе и уменьшил микроглиальную активацию [8]. На модели, имитирующей более тяжелой форму этого заболевания, эмрусолмин несколько улучшил двигательные навыки, но существенно не повлиял на нейродегенерацию или накопление альфа-синуклеина [9].
На мышиных моделях тау-патологии эмрусолмин уменьшил потерю нейронов, улучшил когнитивные способности и продлил выживаемость [10], причем даже у старых мышей он смог обратить вспять нарушения конечного метаболизма глюкозы в головном мозге [11].
На мышиной модели болезни Альцгеймера эмрусолмин восстановил синаптическую пластичность гиппокампа и память [12].
АМБРОКСОЛ
Амброксол (ambroxol) —муколитическое лекарственное средство и основной ингредиент ряда безрецептурных противокашлевых препаратов. В США и Канаде амброксол не зарегистрирован.
Интерес к изучению амброксола в лечении болезни Паркинсона обусловлен его активностью в качестве молекулярного шаперона для лизосомального фермента бета-глюкоцереброзидазы (GCase): мутации с потерей функции в гене GCase (GBA1) ассоциированы с повышенным в 20–30 раз риском развития болезни Паркинсона, причем с более ранним началом и ускоренными когнитивными и моторными ухудшениями [1] [2].
Активность бета-глюкоцереброзидазы и альфа-синуклеина связаны между собой: дефицит GCase вызывает патологическое накопление альфа-синуклеина в клеточных культурах [3], а сверхэкспрессия GCase в головном мозге ослабляет патологию и дефицит памяти в мышиной модели синуклеинопатии [4]. Активность GCase снижена при идиопатической болезни Паркинсона без мутаций GBA1 [5], снижение активности GCase коррелирует с более ранним началом заболевания и ухудшением когнитивных и немоторных симптомов [6]. Мутации GBA1 были первоначально идентифицированы [7] как причина [8] паркинсонизма при болезни Гоше — лизосомальном заболевании, характеризующемся накоплением сфинголипидов и в некоторых случаях патологией альфа-синуклеина.
В клетках, полученных от пациентов с болезнью Гоше или болезнью Паркинсона, амброксол стабилизировал мутантную GCase [9] и способствовал ее перемещению из эндоплазматического ретикулума (ER) в лизосомы [10], повышая уровень белка, активность фермента и функцию лизосом. У мух с мутациями GCH1 амброксол усиливал активность GCase, снижал стресс ER и защищал двигательную функцию [11].
У мышей дикого типа и мышей с мутацией GCH1 амброксол индуцировал активность GCase в головном мозге, а у мышей, сверхэкспрессирующих человеческий альфа-синуклеин, снижал общее количество и уровень фосфорилированного альфа-синуклеина [12]. В мышиной модели бокового амиотрофического склероза амброксол улучшал двигательную функцию и продлевал выживаемость [13].
У здоровых нечеловекообразных приматов ежедневный прием амброксола усиливал активность GCase в головном мозге [14].
Клиническое испытание AiM-PD (NCT02941822) фазы II, проведенное Университетским колледжем Лондона (University College London, UCL, Лондон, Великобритания), продемонстрировало, что ежедневные 1260 мг амброксола (многократно увеличенная доза, применяемая при кашле), назначаемые в течение пяти месяцев, способствовали улучшению показателей по шкале MDS-UPDRS (в особенности моторных функций) у пациентов с болезнью Паркинсона умеренной тяжести [15].
Лоусоновский научно-исследовательский институт здоровья (Lawson Health Research Institute, London, Онтарио, Канада) осуществляет клиническую проверку NCT02914366 фазы II на предмет того, сможет ли амброксол улучшить когнитивные и моторные симптомы при деменции на фоне болезни Паркинсона. Сроки завершения установлены на конец 2025 года [16].
Анализ реальных данных пациентов с болезнь Гоше, в том числе страдающих болезнью Паркинсона на ее фоне, которые принимали амброксол, подтвердил оказываемые им благотворные эффекты, проявляющиеся стабилизацией или улучшением неврологического статуса, увеличением физической активности, снижением утомляемости [17].
ВЕКТОРИЗИРОВАННЫЕ АНТИТЕЛА: VOYAGER THERAPEUTICS
Интересную идею продвигает «Вояджер терапьютикс» (Voyager Therapeutics), придумавшая решение проблемы доставки в головной мозг необходимого количества антител, связывающих патологические белки, в том числе альфа-синуклеин. «Вояджер» занялась вопросом обхождения гематоэнцефалического барьера (ГЭБ), препятствующего проникновению крупных лекарственных молекул. Да, можно осуществлять частые системные инъекции антител, но это не выход, поскольку высока вероятность побочных реакций.
Принцип так называемых векторизированных антител следующий: конструируется аденоассоциированный вирусный вектор (AAV), который несет определенные генетические инструкции, кодирующие нужное моноклональное антитело, синтез которого осуществляется самим организмом прямиком в головном мозге. Заявлено, что однократной внутривенной инъекции AAV-препарата окажется достаточно для оказания должного терапевтического эффекта очень продолжительное время — возможно, пожизненно. Объясняется это тем, что клетками-мишенями в центральной нервной системы в данном случае являются нейроны, долгоживущие и неделящиеся [1].
Всё бы ничего, но в августе 2020 года «ЭббВи» (AbbVie) разорвала с «Вояджер» мощное партнерское соглашение по векторизированным антителам против нейродегенеративных заболеваний.
ПРИРОДНЫЕ ВЕЩЕСТВА
Природные вещества (ПВ) — это соединения, полученные из природных источников, таких как растения, животные и микроорганизмы. С развитием современной химии и фармакологии выделение и характеристика ПВ становятся всё более сложными, открывая новые возможности для поиска лекарств. Многие ПВ обладают значительной биологической активностью и проявляют многообещающие терапевтические эффекты при широком спектре заболеваний.
Определенные природные вещества обладают способностью подавлять агрегацию альфа-синуклеина [1], однако клинических исследований, которые бы безговорочно подтвердили это чрезвычайно мало. Поэтому приходится полагаться либо на теоретические изыскания, либо на ограниченные данные применения ПВ при болезни Паркинсона.
Большую группу среди таких противопаркинсонических ПВ занимают полифенольные соединения: куркумин (curcumin) и его аналоги и производные, ресвератрол (resveratrol), пицеатаннол (piceatannol), катехины зеленого чая, гесперетин (hesperetin) и гесперидин (hesperidin), дигидромирицетин (dihydromyricetin, DHM) и сальвианоловая кислота B (salvianolic acid B, Sal B), рутин (rutin), текторигенин (tectorigenin), байкалеин (baicalein).
Способностью противодействовать нейротоксичным альфа-синуклеиновым агрегатам обладают следующие природные вещества: нафтохиноны (шиконин [shikonin], витамин K), таншиноны, экстракты грибов Ganoderma spp. («Линчжи», «Рейши», «Гриб бессмертия»), экстракты центеллы азиатской (Centella asiatica), производные коричной кислоты (cinnamic acid), экстракты гравилата городского (Geum urbanum), (+)-десдиметилпинорезинол [(+)-desdimethylpinoresinol], алкалоиды (хинолины и индолы, никотин, кофеин, скваламин [squalamine], тродускумин [trodusquemine]), а также пирролохинолинхинон (pyrroloquinoline quinone).