ЧТО ПРОИЗОШЛО
«Отувэйр» (Ohtuvayre, энсифентрин) — новый лекарственный препарат, предназначенный для поддерживающей терапии хронической обструктивной болезни легких (ХОБЛ) у взрослых.
ОСНОВНЫЕ ФАКТЫ
Прорыв в лечении хронической обструктивной болезни легких (ХОБЛ): впервые за 20 лет появился препарат с новым механизмом действия.
Энсифентрин (ensifentrine) — инновационное лекарство двойного действия, которое расширяет бронхи и борется с воспалением.
Эксперты в восторге: «важное достижение медицинской науки» и «большой шаг вперед в лечении ХОБЛ».
Впечатляющие результаты: значительное улучшение дыхательной функции и качества жизни пациентов.
Снижает частоту обострений ХОБЛ на 36–43% — надежда для миллионов больных.
Длительная и упорная история создания: от забытой молекулы до готового препарата.
Потенциальный бестселлер: прогноз продаж в США — $1,1 млрд в год.
«Отувэйр» (Ohtuvayre, энсифентрин), разработанный «Верона фарма» (Verona Pharma), одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в конце июня 2024 года [1].
В Старом Свете энсифентрин, если заручится маркетинговым разрешением Европейского агентства по лекарственным средствам (EMA), получит, возможно, иное название: например, «Винэйр» (Wynayre), «Винфидра» (Wynfidra), «Винзефр» (Wynzephr), «Тринэйро» (Trinayro), «Зунхэйр» (Zunhayre).
ПРЯМАЯ РЕЧЬ
«Несмотря на поддерживающую терапию, большинство пациентов с ХОБЛ ежедневно сталкиваются с симптомами, такими как одышка и постоянный кашель. На протяжении двух десятилетий инновации в области ингаляционных методов лечения ограничивались комбинациями существующих классов препаратов. Энсифентрин — важное достижение медицинской науки».
Майкл Уэллс (Michael Wells), заведующий отделением легочной и реанимационной медицины в Медицинском центр ветеранов Бирмингема и медицинский директор Центра здоровья легких при Университете Алабамы в Бирмингеме (США).
«Энсифентрин снижает количество обострений ХОБЛ при комбинировании с некоторыми ингаляционными препаратами и хорошо переносится. Однако существует неопределенность, какую именно пользу он предоставит в сочетании с неизученными ингаляционными лекарственными средствами».
Дэвид Ринд (David Rind), медицинский директор Института клинико-экономической экспертизы США (ICER).
«Мы воодушевлены потенциалом энсифентрина, способным переосмыслить лечение ХОБЛ во всём мире. Мы стремимся как можно скорее предоставить эту первоклассную терапию пациентам в Китае, имеющем самый большой контингент пациентов на планете».
Марк Лоттер (Mark Lotter), основатель и исполнительный директор «Нюанс фарма» (Nuance Pharma).
«„Отувэйр“ применяется дважды в день при помощи стандартного струйного небулайзера, сеанс длится от пяти до семи минут. Приблизительно половина пациентов с ХОБЛ уже пользуются подобными портативными устройствами. Трудностей обычно ни у кого не возникает».
Крис Мартин (Chris Martin), коммерческий директор «Верона фарма» (Verona Pharma).
«Одобрение препарата „Отувэйр“ — большой шаг вперед в лечении ХОБЛ. Энсифентрин, благодаря своей бронходилататорной и нестероидной противовоспалительной активности, изменит традиционный медицинский подход к терапии этого заболевания, неизменный вот уже 20 лет».
Дэвид Заккарделли (David Zaccardelli), президент и исполнительный директор «Верона фарма» (Verona Pharma).
СУТЬ ВОПРОСА
Хроническая обструктивная болезнь легких (ХОБЛ) характеризуется прогрессирующей и частично обратимой обструкцией воздушного потока, хроническим воспалением, ремоделированием дыхательных путей и избыточной выработкой слизи, что приводит к ежедневным симптомам и обострениям, негативно влияющим на качество жизни [1] [2].
Стандартные методы лечения ХОБЛ, неизменные вот уже четыре десятка лет, включают такие лекарственные препараты, как ингаляционные бронходилататоры короткого и длительного действия, представленные антагонистами мускариновых рецепторов (антихолинергики) и бета-агонистами (бета-2-адреномиметики). Применяются также ингаляционные кортикостероиды.
Несмотря на богатый ассортимент препаратов вышеуказанных классов и наличие их разнообразных двойных и тройных комбинаций, у пациентов с ХОБЛ всё равно сохраняется выраженная симптоматика, обременяющая повседневную жизнь, в том числе из-за непрекращающихся обострений [3] [4].
Для профилактики обострений ХОБЛ широко используются ингаляционные кортикостероиды, притом что их использование явно ассоциировано с повышенным риском развития пневмонии, включая ведущую к госпитализации [5] [6]. У некоторой части пациентов, которым назначают ингаляционные бронходилататоры длительного действия, существует риск сердечно-сосудистых заболеваний и заболеваний мочевыводящих путей, что подтверждает необходимость альтернативной терапии, индивидуализированной под особенности больных [7] [8].
Новые методы лечения ХОБЛ должны обеспечивать дополнительную бронходилатацию, оказывать противовоспалительное действие, облегчать бремя симптомов и предотвращать обострения ХОБЛ — и всё это на фоне благоприятного профиля безопасности. Разработка новых способов лечения ХОБЛ не отличается должной активностью [9] [10] [11].
БОЛЬШИЕ ЧИСЛА
С учетом того, что в США, как ключевом рынке сбыта любой фармацевтической продукции, насчитывается свыше 8,6 млн пациентов с ХОБЛ [1], у половины больных заболевание остается симптоматичным, несмотря на интенсивное лечение [2], поддерживающая фармакотерапия ограничена тремя механизмами действия [3], а объемы продаж наиболее востребованных ХОБЛ-препаратов и их комбинаций превысили $10 млрд в 2021 году, «Отувэйр» (Ohtuvayre, энсифентрин) обладает неплохими перспективами для высокого спроса.
Согласно прогнозам самой «Верона фарма» (Verona Pharma), продажи энсифентрина (ensifentrine) в США доберутся до $1,1 млрд в год. Аналитики компании исходили из следующих предположений: к «Отувэйр» обратится хотя бы 1% американских пациентов из 8,6 млн человек и будет им пользоваться 6 месяцев в году; прейскурантная цена препарата составляет $2950 в месяц, из нее следует вычесть скидку в 25%.
КАК ЭТО РАБОТАЕТ
Ингибиторы фосфодиэстеразы 3 (PDE3) и фосфодиэстеразы 4 (PDE4) воздействуют на целый ряд дыхательных функций [1]. Так, PDE3 регулирует циклический аденозинмонофосфат (цАМФ) и циклический гуанозинмонофосфат (цГМФ) в гладкой мускулатуре дыхательных путей, что опосредует тонус бронхов [2] [3] [4].
PDE4 регулирует цАМФ и участвует в активации и миграции воспалительных клеток, а также в стимуляции муковисцидозного трансмембранного регулятора проводимости (CFTR) в эпителиальных клетках бронхов, что способствует уменьшению вязкости слизи и стимулированию мукоцилиарного клиренса [5] [6] [7] [8] [9].
Одновременное ингибирование PDE3 и PDE4 — по сравнению с ингибированием только PDE3 или PDE4 — продемонстрировало усиленный или синергический эффект на сокращение гладкой мускулатуры дыхательных путей и подавление воспалительного ответа [10] [11] [12]. Подобный двойной механизм действия является перспективной стратегией лечения обструктивных и воспалительных заболеваний дыхательных путей, таких как ХОБЛ, муковисцидоз и астма.
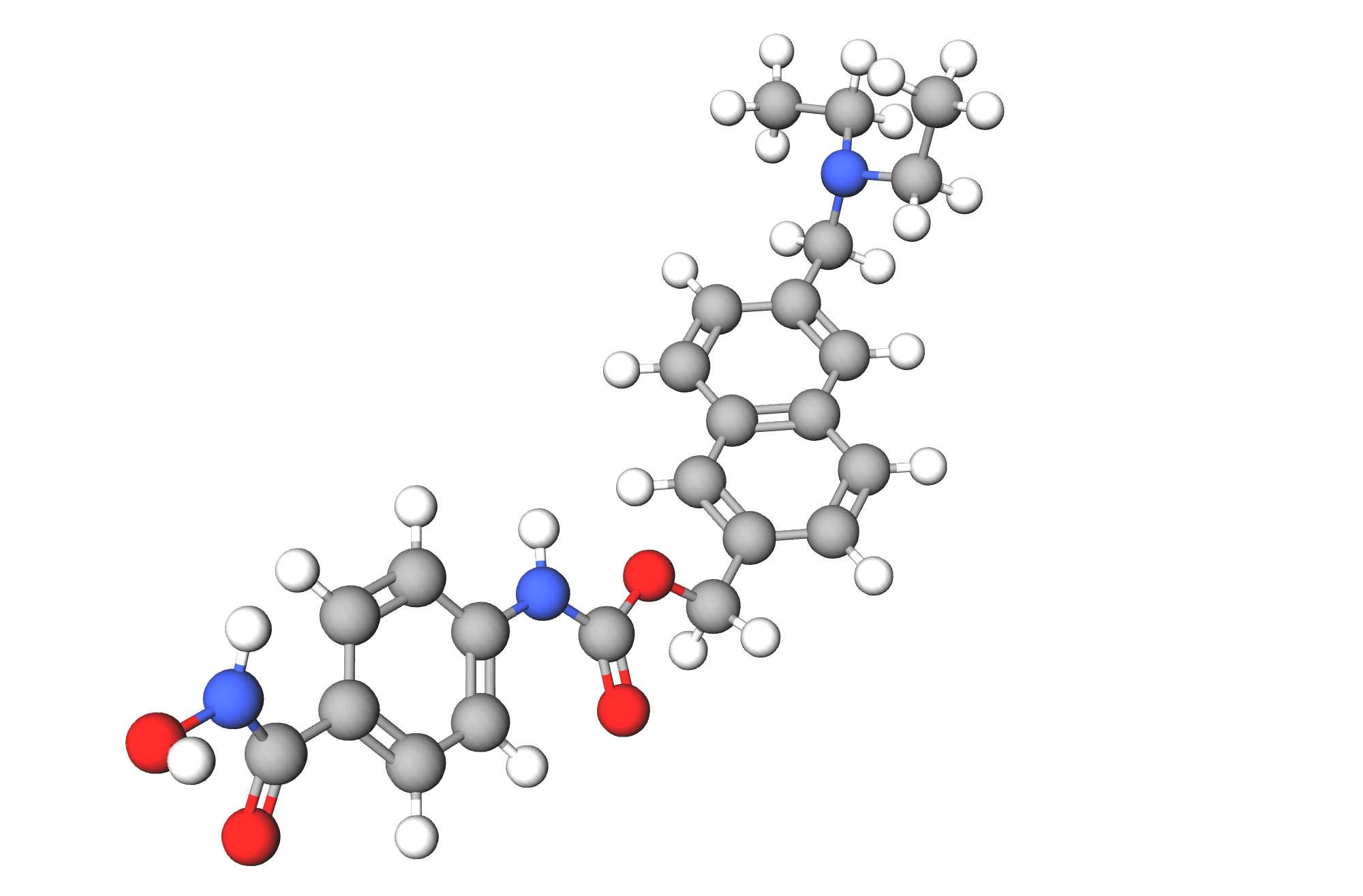
Энсифентрин (ensifentrine, RPL554) — первый в своем классе ингаляционный низкомолекулярный селективный двойной ингибитор PDE3 и PDE4, сочетающий в одной молекуле эффекты благотворного воздействия на гладкую мускулатуру дыхательных путей, воспалительные процессы и стимуляцию CFTR [13] [14] [15] [16] [17] [18].
Энсифентрин не ассоциирован с нежелательными явлениями со стороны желудочно-кишечного тракта, расхожими при системном PDE4-ингибировании.
Оригинатором энсифентрина является британская «Верналис» (Vernalis), впоследствии ставшая частью «Лиганд фармасьютикалс» (Ligand Pharmaceuticals). В феврале 2005 года «Верналис» лицензировала молекулу британской «Ринофарма» (Rhinopharma). В августе 2006 года последняя сменила название на «Верона фарма» (Verona Pharma) [19].

ИНТЕРЕСНЫЙ ФАКТ
Энсифентрин (ensifentrine) был открыт четыре десятилетия назад шотландским фармакологом сэром Дэвидом Джеком (David Jack) [1924–2011], возглавлявшим отдел исследований и разработок «Аллен и Хенбери» (Allen & Hanburys), в 1958 году поглощенной «Глаксо лабораториз» (Glaxo Laboratories), впоследствии ставшей «ГлаксоСмитКляйн» (GlaxoSmithKline). Энсифентрин долгое время оставался на полке ввиду неразрешаемой проблемы со стабильностью, пока упорство «Верона фарма» (Verona Pharma) с ней не справилось. На это понадобилось 19 лет и почти 20 клинических испытаний.
На счету команды ученых по руководством Джека множество открытий и внедрений до сих пор популярных и востребованных лекарственных соединений, включая беклометазон (beclometasone, 1962), сальбутамол (salbutamol, 1966), лабеталол (labetalol, 1966), ранитидин (ranitidine, 1977), суматриптан (sumatriptan, 1984), сальметерол (salmeterol, 1985), ондансетрон (ondansetron, 1987), флутиказон (fluticasone, 1993) [1].
КЛИНИЧЕСКИЕ ПОДРОБНОСТИ
Опорная клиническая программа энсифентрина (ensifentrine) представлена одинаковыми по дизайну клиническими исследованиями фазы III (рандомизированными, двойными слепыми, плацебо-контролируемыми, многоцентровыми, международными), ENHANCE-1 (NCT04535986) и ENHANCE-2 (NCT04542057), продолжительностью соответственно 48 недель и 24 недели.
Исследования пригласили взрослых (40–80 лет) пациентов (n=760 и n=789) с умеренно-тяжелой хронической обструктивной болезнью легких (ХОБЛ).
Среди основных требований к участникам:
- объем форсированного выдоха за 1-ю секунду (ОФВ1) в пределах 30–70% от расчетной нормы — после ингаляции бронходилататора (альбутерола или сальбутамола);
- отношение объема воздуха при форсированном выходе к форсированной жизненной емкости легких (ОФВ1 / ФЖЕЛ) < 0,70 — до и после ингаляции бронходилататора;
- ≥ 2 баллов по модифицированной шкале одышки Медицинского исследовательского совета (mMRC);
- не менее чем 10-летний стаж курения.
Испытуемым назначали дважды в день ингаляционный энсифентрин (3 мг) или плацебо — на фоне продолжения стандартного лечения ХОБЛ, если таковое проводилось.
Первичная конечная точка эффективности лечения ХОБЛ, оцениваемая после 12 недель терапии, была заявлена усредненным изменением площади под кривой (AUC) показателя ОФВ1 в период 0–12 часов после приема препарата.
Группы энсифентрина продемонстрировали статистически значимое (p<0,0001) изменение первичной конечной точки относительно групп плацебо: на 87 (95% ДИ [здесь и далее]: 55–119) мл и 94 (65–124) мл — соответственно в ENHANCE-1 и ENHANCE-2 [1].
Улучшение респираторной функции оказалось справедливым вне зависимости от исходных характеристик пациентов, таких как пол, возраст, статус курильщика, тяжесть ХОБЛ, особенности фонового лечения, использование ингаляционных кортикостероидов, статус хронического бронхита, обратимость ОФВ1, географический регион проживания.
Назначение энсифентрина отразилось следующим улучшением вторичных конечных точек респираторной функции относительно применения плацебо после 12 недель лечения:
- рост пикового ОФВ1 в период 0–4 часов после приема препарата на 147 (111–183) мл и 146 (113–179) мл (p<0,0001);
- рост ОФВ1 утром до приема препарата на 35 (1–68) мл и 49 (19–80) мл (p=0,041 и p=0,002).
После 24 недель лечения группы энсифентрина отметились улучшением симптоматики, согласно шкале оценки симптомов (E-RS): разница с плацебо −1,0 (−1,7, −0,2) балла и −0,6 (−1,4, +0,2) балла (p=0,011 и p=0,134).
Применение энсифентрина улучшило качество жизни, согласно респираторному опроснику больницы Св. Георгия (SGRQ): разница с плацебо −2,3 (−4,3, −0,3) балла и −0,5 (−2,7, +1,7) балла (p=0,025 и p=0,669).
Энсифентрин снизил необходимость в обращении к резервным препаратам для купирования обострений ХОБЛ и улучшил симптомы одышки, согласно шкале динамического индекса одышки (TDI).
Наблюдения в течение 24 недель установили, что назначение энсифентрина привело к снижению частоты умеренно-тяжелых обострений ХОБЛ (на 36% и 43% относительно плацебо [p=0,050 и p=0,009]) и продлению времени до наступления первого такого события (на 38% и 42% [p=0,038 и p=0,009]).
Энсифентрин характеризовался приемлемой переносимостью. Значимых расхождений с группой плацебо по частоте нежелательных явлений не зафиксировано.










КОНТРАРГУМЕНТЫ
Бизнес-позиции «Верона фарма» (Verona Pharma) шатки, ведь энсифентрин (ensifentrine) доводится до ума так долго, что от его патентной защиты практически ничего не осталось. Патентная слабость объясняет отсутствие партнерских договоренностей с кем-либо из крупных мировых фармпроизводителей на предмет совместной разработки и коммерциализации молекулы.
«Верона», очевидно, придется напирать на традиционные способы охраны интеллектуальной собственности: к примеру, запатентованные ингаляционные рецептуры энсифентрина (полиморфы, суспензии, соли, комбинации) могут отсрочить падение патентного щита до середины 2030-х гг., а статус орфанного препарата в США наделяет правом семилетней рыночной исключительности.
Разве что в июне 2021 года «Верона» выдала китайской «Нюанс фарма» (Nuance Pharma) исключительные права на разработку и коммерциализацию энсифентрина в Поднебесной. Взамен «Верона» получила от «Нюанс байотек» (Nuance Biotech), материнской для «Нюанс фарма», аванс в размере $40 млн с обещанием будущих выплат до $179 млн по мере продвижения лекарства, плюс роялти от реализации готового препарата [1].
ЧТО ДАЛЬШЕ
Теперь, когда энсифентрин (ensifentrine) наконец-то коммерциализирован, «Верона фарма» (Verona Pharma) может ускорить клиническую разработку молекулы в целях расширения спектра ее терапевтических показаний за счет пациентов с немуковисцидозным бронхоэктазом, муковисцидозом, астмой. В планах стоит выпуск комбинации энсифентрина с гликопирронием (glycopyrronium), антагонистом мускариновых рецепторов длительного действия.
ЭКСПЕРТНЫЕ КОММЕНТАРИИ
Дополнительный бронхорасширяющий эффект препарата «Отувэйр» (Ohtuvayre, энсифентрин), достигнутый за относительно короткий курс лечения пациентов с хронической обструктивной болезнью легких (ХОБЛ), прежде считавшихся вышедшими к максимальному ответу на двойную или тройную стандартную терапию, заставляет позиционировать энсифентрин (ensifentrine) востребованным лекарственным средством, которое однозначно пригодится при тяжелых формах этого прогрессирующего и инвалидизирующего заболевания.
Оценочно у половины пациентов ХОБЛ не контролируется должным образом, оставаясь симптоматичной и с рисками обострений, и потому многие не удовлетворены лечением [1] [2]. Во всём мире ХОБЛ, которой страдают свыше 390 млн человек [3], — третья ведущая причина смерти [4].
Благодаря тому, что регуляторное разрешение выдано энсифентрину без каких-либо ограничений на его использование с другими ХОБЛ-препаратами и без необходимости учета особенностей заболевания, он пригодится абсолютно всем пациентам, которые нуждаются в улучшении исходов лечения.
«Верона фарма» (Verona Pharma) установила прейскурантную цену энсифентрина в размере $2950 в месяц, то есть $35400 в год. Согласно анализу Института клинико-экономической экспертизы США (ICER), приемлемой стоимостью поддерживающей терапии ХОБЛ при помощи энсифентрина следует считать сумму в диапазоне от $7500 до $12700 в год [5]. Не исключено, политика ценообразования, которой следует «Верона», приведет к заминкам включения препарата в формуляры поставщиков страховых медицинских услуг.