ЧТО ПРОИЗОШЛО
«Имделтра» (Imdelltra, тарлатамаб) — новый лекарственный препарат, предназначенный для лечения мелкоклеточного рака легкого (МРЛ) на распространенной стадии у взрослых пациентов, который прогрессировал во время или после платиносодержащей химиотерапии.
ОСНОВНЫЕ ФАКТЫ
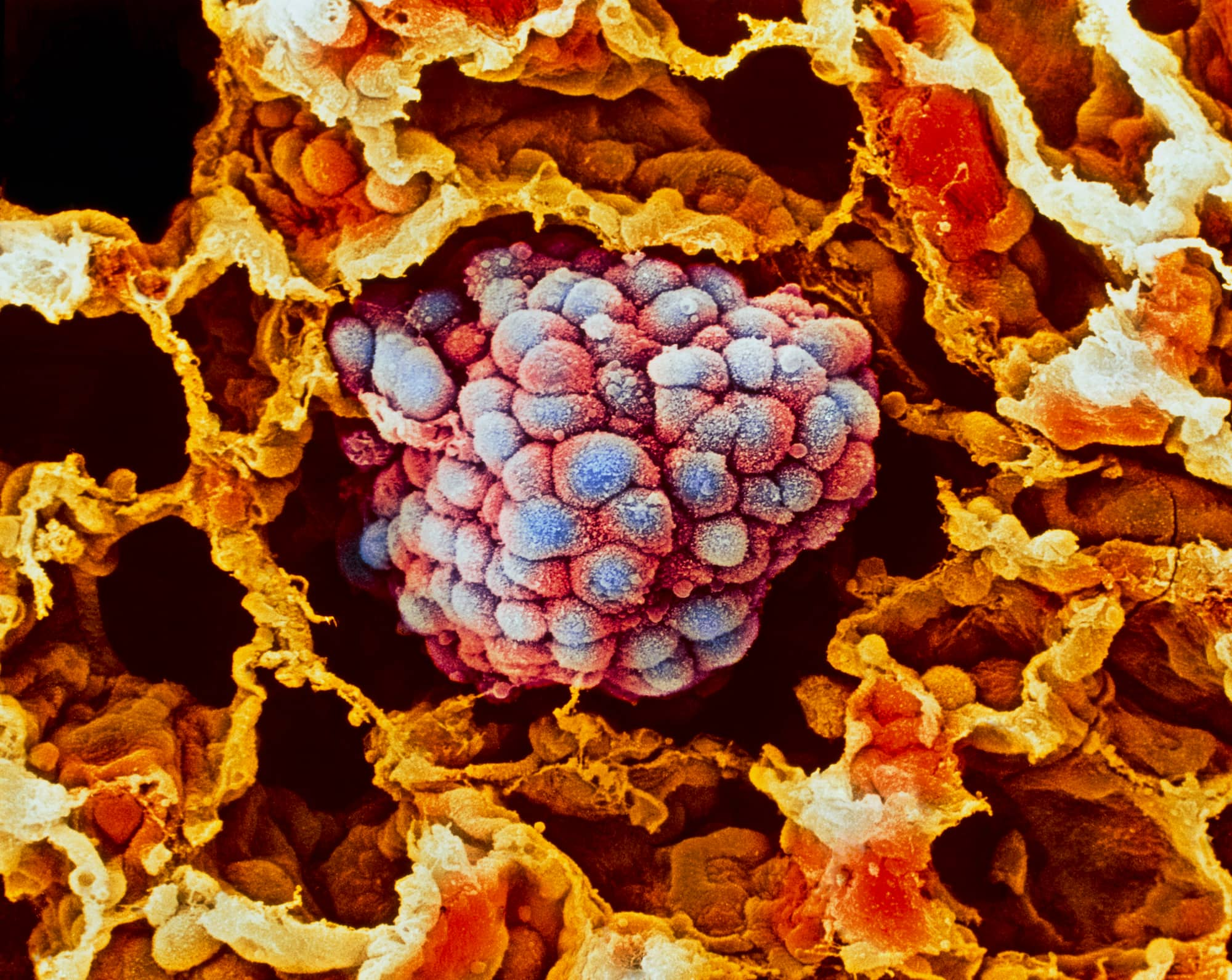
Мелкоклеточный рак легкого (МРЛ), будучи в целом неизлечимым заболеванием, по-прежнему остро нуждается в новых лекарственных средствах.
Тарлатамаб (tarlatamab), разработанный «Амджен» (Amgen), таргетирован на дельта-подобный лиганд 3 (DLL3) — привлекательную терапевтическую мишень ввиду ее высокой специфичности при МРЛ.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило «Имделтра» (Imdelltra, тарлатамаб) в середине мая 2024 года [1].
Регуляторный вердикт вынесен в условном порядке, то есть препарату предстоит окончательно подтвердить собственную терапевтическую эффективность.
Тарлатамаб относится к классу лекарственных соединений, называемых привлекающими T-клетки биспецифическими активаторами (bispecific T cell engager, BiTE). Это синтетические биспецифические моноклональные антитела, направляющие T-клеточную цитотоксическую активность иммунной системы организма против раковых клеток.
Инструкция по медицинскому применению лекарственного препарата «Имделтра» снабжена чернорамочным предупреждением о рисках развития синдрома выброса цитокинов (CRS) и неврологической токсичности, включая синдром нейротоксичности, ассоциированный с иммунными эффекторными клетками (ICANS). Эти нежелательные явления могут быть серьезными или жизнеугрожающими.
Для американских пациентов стоимость лечения препаратом «Имделтра» составляет $31,5 тыс. в первом 28-дневном терапевтическом цикле и $30 тыс. в каждом последующем. В среднем терапия обойдется в $166,5 тыс., если исходить из продолжительности лечения в 5,5 циклов.
Согласно отраслевым прогнозам, к 2028 году продажи «Имделтра» доберутся до $850 млн. Пиковый спрос, как предполагается, превысит $2 млрд.

ПРЯМАЯ РЕЧЬ
«Распространенный МРЛ — сложное и тяжелое заболевание, и менее 3% пациентов живут дольше пяти лет. Удивительно стойкие ответы на назначение тарлатамаба представляют собой серьезный прорыв в лечении».
Дэвид Кэрбон (David Carbone), директор Центра торакальной онкологии Джеймса при медицинском центре Университета штата Огайо (США).
«После десятилетий минимального прогресса в лечении МРЛ на распространенной стадии наконец-то появился эффективный препарат против этого агрессивного заболевания».
Лори Фентон Амброуз (Laurie Fenton Ambrose), соучредитель, президент и исполнительный директор «Вместе против рака легкого» (GO2 for Lung Cancer).
«Обеспечиваемое тарлатамабом приблизительно трехкратное увеличение продолжительности выживания — переломный момент для пациентов и их семей».
Пол Бертон (Paul Burton), медицинский директор «Амджен» (Amgen).
«Одобрение препарата „Имделтра“ знаменует собой поворотный момент для пациентов с МРЛ на распространенной стадии».
Джей Брэднер (Jay Bradner), исполнительный вице-президент по исследованиям и разработкам и директор по науке «Амджен» (Amgen).
СУТЬ ВОПРОСА
Мелкоклеточный рак легкого (МРЛ) — агрессивная высокозлокачественная нейроэндокринная опухоль (НЭО), на долю которой ежегодно приходится 13–15% диагнозов рака легкого [1] [2] [3]. Прогноз для пациентов с МРЛ неутешителен: 5-летняя выживаемость составляет от 27% для пациентов с локализованным заболеванием и до 3 % — с метастатическим [1].
На момент постановки диагноза мелкоклеточного рака легкого он зачастую находится на поздней стадии и характеризуется быстрым, ускоренным вдвое прогрессированием (по сравнению с немелкоклеточным), склонностью к раннему метастазированию, а также недолгосрочными ответами на существующие стандартные методы лечения, за которыми почти всегда следуют развитие лекарственной устойчивости и рецидив [4] [5].
В совокупности указанные факторы привели к тому, что МРЛ стали называть не поддающимся лечению раком, ведь подавляющему большинству пациентов не удается достичь долгосрочного контроля над заболеванием с помощью доступных на сегодня способов терапии. Ни одно таргетное лечение против МРЛ не показало себя лучше, чем существующие методы терапии — даже в исследованиях со специально отобранными группами пациентов [6].
Сейчас первоочередное лечение мелкоклеточного рака легкого осуществляется платиносодержащей химиотерапией (цисплатин с этопозидом или карбоплатин с этопозидом) с сопутствующей лучевой терапией — при МРЛ на локализованной стадии; вслед за этим пациенты с полным ответом проходят профилактическое облучение черепа [7] [8]. При МРЛ на распространенной стадии назначают такую же химиотерапию препаратами платины, дополненную блокатором PD-L1 [8].
Химиотерапевтический топотекан свыше двух десятилетий был единственным одобренным лекарственным средством для терапии второй линии МРЛ — пока в середине 2020 года ни появился лурбинектедин против рецидивирующего МРЛ [7] [9] [10].

«Зепзелка»: новое лекарство против мелкоклеточного рака легкого
Лурбинектедин должен стать новым стандартом терапии второй линии МРЛ вместо топотекана.
Ни один лекарственный препарат или терапевтическая схема не получили одобрения регуляторов для лечения мелкоклеточного рака легкого, который не отвечает на терапию или рецидивирует после двух или более линий терапии. Скромное улучшение клинических исходов при использовании существующих методов лечения и практически неизбежное развитие резистентности и рецидивы после первоочередной химиотерапии служат мощным стимулом для постоянного поиска более эффективных фармакологических подходов.
Ингибиторы иммунных контрольных точек (ИИКТ) значительно улучшили результаты лечения пациентов с куда более часто встречающимся немелкоклеточным раком легкого (НМРЛ) и многими иными видами солидных опухолей. Несмотря на то что высокий уровень опухолевых мутаций, наблюдаемый при МРЛ, коррелирует с улучшением ответа на назначение ИИКТ [2] [11], добавление последних к первоочередной химиотерапии обеспечило преобразующий эффект лишь у небольшой группы пациентов, причем, согласно раннему ретроспективному анализа, такой эффект, скорее всего, ограничен пациентами с изначально более воспаленными опухолями [12] [13] [14].
Без оглядки на очевидное отсутствие пользы, установленное в краткосрочных исследованиях применения ИИКТ против МРЛ, следует отметить, что обновленные данные долгосрочных наблюдений за пациентами с прежде нелеченным МРЛ на запущенной стадии из клинических испытаний CASPIAN (NCT03043872) и KEYNOTE-604 (NCT03066778) выявили следующее: длительная поддерживающая терапия (свыше 3 лет в первом исследовании и до 35 циклов лечения во втором) путем назначения ИИКТ и химиопрепаратов привела к значительному улучшению общей выживаемости по сравнению с химиотерапией только этопозидом и платиной — в течение 3 лет в живых осталось втрое больше пациентов [12] [13].
Резистентность к ИИКТ-терапии при мелкоклеточном раке легкого, есть мнение, обусловлена несколькими факторами, включая снижение регуляции молекул главного комплекса гистосовместимости (MHC), нарушение презентации антигена, высокую внутриопухолевую гетерогенность [15] [16].
КАК ЭТО РАБОТАЕТ
Одна из стратегий обхода недостаточности канонических путей антиген-презентации заключена в нацеливании на альтернативный белок, находящийся на клеточной поверхности опухолевой клетки. Дельта-подобный лиганд 3 (DLL3) — привлекательная опухолеспецифическая мишень благодаря тому, что этот белок характеризуется уникальной сверхэкспрессией на клеточной поверхности клеток мелкоклеточного рака легкого (МРЛ) и других высокозлокачественных нейроэндокринных образований (НЭО) [1].
Ген DLL3 кодирует ингибиторный лиганд, подавляющий Notch-сигнализацию в клетках МРЛ [2]. Сигнальный Notch-путь является эволюционно консервативным, а Notch-сигнализация при МРЛ вовлечена в многочисленные онкогенные клеточные процессы, такие как клеточная пролиферация, пластичность нейроэндокринных клеток, дифференцировка, химиорезистентность и модуляция иммунного микроокружения [3].
DLL3 — атипичный лиганд Notch, сверхэкспрессия которого способствует росту клеток МРЛ и усиливает их миграционную и инвазивную способность [4]. DLL3 участвует в формировании метастатического и резистентного к лечению фенотипа при НЭО, способствуя пролиферации клеток и приобретению устойчивости к платиносодержащей химиотерапии [5] [6].
Экспрессия DLL3 в нормальных клетках находится на низком уровне, будучи в основном ограниченной внутриклеточно (аппаратом Гольджи и цитоплазматическими везикулами), тогда как в клетках МРЛ она повышена и перемещается на их поверхность [7]. Считается, что в физиологических условиях трансмембранная область и фланкирующие последовательности в белке DLL3 действуют как сдерживающий сигнал, который не только ограничивает DLL3 внутриклеточной локализацией, но и организует его экспрессию на минимальном или вовсе отсутствующем уровне [8].
Значительная сверхэкспрессия белка DLL3 приводит к аберрантной экспрессии на клеточной поверхности [8], как это наблюдается при МРЛ, хотя молекулярные механизмы, лежащие в основе сверхэкспрессии DLL3 в трансформированных клетках, еще не до конца определены. До 85–94% опухолей МРЛ экспрессируют белок DLL3 на своей клеточной поверхности [1] [9] [10].
DLL также широко экспрессирует при других НЭО, таких как легочная нейроэндокринная опухоль, гастроэнтеропанкреатическая, мочевого пузыря, простаты, шейки матки [11]. Высокий уровень экспрессии DLL3 коррелирует с прогрессированием заболевания и плохими исходами по показателю выживаемости [11].
Тарлатамаб (tarlatamab, AMG 757), разработанный «Амджен» (Amgen), относится к классу лекарственных соединений, называемых привлекающими T-клетки биспецифическими активаторами (bispecific T cell engager, BiTE). Это синтетические биспецифические моноклональные антитела, направляющие T-клеточную цитотоксическую активность иммунной системы организма против раковых клеток [12].
Тарлатамаб располагает двойным сродством к DLL3 на опухолевых клетках и CD3 на Т-клетках. Молекула тарлатамаба состоит из двух одноцепочечных вариабельных фрагментов (scFv), соединенных коротким гибким линкером, и включает стабильный, не имеющий эффекторных функций домен кристаллизующегося фрагмента (Fc), который необходим для продления периода полувыведения [13] [14].
Тарлатамаб формирует цитолитический синапс путем одновременного связывания с опухолевыми клетками и Т-клетками, что отражается активацией и пролиферацией Т-клеток, а также транзиторной выработкой цитокинов. Активированные Т-клетки высвобождают порообразующие ферменты, такие как перфорин и гранзим В, которые вызывают апоптоз опухолевых клеток [15] [16]. Пролиферация активированных Т-клеток приводит к росту количества эффекторных Т-клеток вблизи опухоли с последующим усилением противоопухолевого эффекта [17].
КЛИНИЧЕСКИЕ ПОДРОБНОСТИ
Клиническое исследование DeLLphi-301 (NCT05060016) фазы II (рандомизированное, открытое, многоцентровое, международное) охватило взрослых пациентов (n=188) с мелкоклеточным раком легкого (МРЛ) на распространенной стадии, уже прошедшим хотя бы две линии терапии.
Среди основных требований к участию: прогрессирование или рецидив МРЛ вслед за одной линией платиносодержащей химиотерапии и как минимум одной линией другой терапии.
Испытуемым назначали тарлатамаб (tarlatamab) внутривенно каждые 2 недели в дозе 10 мг или 100 мг — до момента прогрессирования заболевания.
Среди основных характеристик пациентов: медиана возраста 66 лет (49–80) и 62 года (34–80), мужчин 71% и 70%; метастатическое заболевание у 94% и 93%, метастазирование в головной мозг у 12% и 36%, в печень у 35% и 34%; медианное число ранее проведенных курсов лечения 2,0 (2–6) и 2,0 (1–8), число предшествовавших линий терапии — 2 (65% и 55%), 3 (18% и 25%), свыше трех (18% и 18%), применение блокатора PD-(L)1 — 82% и 70%.
По прошествии наблюдений на протяжении медианных 10,6 месяца (95% ДИ [здесь и далее]: 9,2–11,3) и 10,3 месяца (9,2–11,5) в группах 10- и 100-мг дозы тарлатамаба результаты получились следующими [1].
Частоты объективного ответа (ORR) составили 40% (29–52) и 32% (21–44) — соответственно в вышеуказанных группах. При этом частоты полных ответов (CR) получились равными 1% и 8%, частоты частичных ответов (PR) — 39% и 24%.
Медианы длительности ответа (DoR) достигнуты не были: NE (5,9–NE) и NE (6,6–NE). Ответ на протяжении как минимум 6 месяцев был зарегистрирован среди 58% и 61% пациентов, хотя бы 9 месяцев — 25% и 36%.
Частоты контроля заболевания (DCR): 70% (60–79) и 63% (52–73). Медианы длительности контроля заболевания: 6,9 месяца (5,4–9,7) и 6,7 месяца (4,2–NE).
Медианы выживаемости без прогрессирования (PFS) составили 4,9 месяца (2,9–6,7) и 3,9 месяца (2,6–4,4).
Оценочные вероятности сохранения статуса PFS на протяжении 6 месяцев: 40% (30–50) и 34% (24–45); на протяжении 9 месяцев: 28% (19–38) и 27% (17–37).
Оценочные вероятности общей выживаемости (OS) в течение 6 месяцев: 73% (63–81) и 71% (60–80); в течение 9 месяцев: 68% (57–77) и 66% (54–75).
Среди наиболее распространенных нежелательных явлений (НЯ) при назначении 10- и 100-мг дозы тарлатамаба: синдром выброса цитокинов (у 51% и 61% пациентов, в основном с легко-умеренной степенью выраженности), снижение аппетита (29% и 44%), пирексия (35% и 33%), запор (27% и 25%), анемия (26% и 25%).
Со связанными с лечением НЯ в тяжелой форме (или хуже) столкнулись 26% и 33% испытуемых. По причине таких НЯ пропустить дозу тарлатамаба или снизить ее пришлось 13% и 29% участников, а полностью прекратить лечение — 3% и 3%. Один пациент (1%) в 10-мг группе тарлатамаба умер вследствие НЯ, проявившегося как дыхательная недостаточность, которая развилась по причине лечения.
Cиндром нейротоксичности, ассоциированный с иммунными эффекторными клетками (ICANS), и связанные неврологические события были зарегистрированы среди 8% и 28% человек.





ЧТО ДАЛЬШЕ
«Амджен» (Amgen) продолжает клиническое изучение тарлатамаба (tarlatamab) в лечении мелкоклеточного рака легкого (МРЛ):
- DeLLphi-302 (NCT04885998) фазы Ib: тарлатамаб вместе с AMG 404, экспериментальным блокатором PD-1, — терапия МРЛ второй линии или позже;
- DeLLphi-303 (NCT05361395) фазы Ib: тарлатамаб на фоне стандартной терапии (карбоплатин и этопозид вкупе с атезолизумабом или дурвалумабом) — первоочередное лечение МРЛ на распространенной стадии;
- DeLLphi-304 (NCT05740566) фазы III: мононазначение тарлатамаба в сравнении со стандартной терапией (лурбинектедин, топотекан, амрубицин) — терапия второй линии МРЛ;
- DeLLphi-306 (NCT06117774) фазы III: моноприменение тарлатамаба после химиолучевой терапии при МРЛ на ранней стадии.
Тарлатамаб также тестируется в DeLLpro-300 (NCT04702737) фазы Ib среди пациентов с нейроэндокринным раком предстательной железы, ранее прошедших хотя бы одну линию терапии.
ЭКСПЕРТНЫЕ КОММЕНТАРИИ
Тарлатамаб (tarlatamab), прошедший клиническое испытание DeLLphi-301 (NCT05060016) фазы II, проявил стойкую противоопухолевую активность у ранее лечившихся пациентов с мелкоклеточным раком легкого (МРЛ).
Назначение тарлатамаба в более низкой дозе (10 мг) было выбрано для последующих исследований этого препарата, поскольку характеризовалось более благоприятным соотношением пользы и риска, чем 100-мг доза.
Объективный ответ был достигнут 40% пациентов, и он значительно превысил исторический контрольный показатель в 15% [1] [2]. Медиана длительности ответа (DoR) еще не установилась, медиана общей выживаемости (OS) зафиксировалась на 14,3 месяца. Продемонстрированная терапевтическая эффективность особенно примечательна с учетом того, что до сих пор не предложено одобренных методов лечения МРЛ в рамках терапии, следующей за второй линией.
Результаты испытания уместно рассматривать в контексте реальных исследований препаратов для третьей и последующих линий терапии, в которых частота объективного ответа (ORR) уложилась в 14–21%, медиана DoR не превысила 3 месяца, а медиана OS ограничилась 6 месяцами [3] [4] [5] [6] [7].
Более того, клинические исходы, обеспеченные тарлатамабом, выглядят многообещающими при их сравнении с таковыми в ходе второлинейного назначения современных стандартных препаратов: топотекана (ORR 17% и 24%, медиана DoR 3,6 и 4,2 месяца, медиана OS 6,3 и 7,8 месяца [8] [9]) и лурбинектедина (ORR 35%, медиана DoR 5,3 месяца, медиана OS 9,3 месяца [10]).
Тарлатамаб представляет собой совершенно новый иммунотерапевтический подход к мелкоклеточному раку легкого — типу опухоли, характеризующемуся иммуносупрессивным микроокружением [11] [12]. Хотя блокаторы PD-L1 входят в стандартную схему химиоиммунотерапии МРЛ на распространенной стадии, снижение регуляции белков класса I главного комплекса гистосовместимости (MHC-I) является распространенным механизмом ухода от иммунного надзора [13]. При этом тарлатамаб не полагается на экспрессию MHC-I, то есть его терапевтическое действие не зависит от презентации пептидного антигена и специфичности T-клеточного рецептора (TCR) — вместо этого он приводит Т-клетки в непосредственную близость к опухолевым клеткам МРЛ путем связывания DLL3 и CD3, что отражается образованием цитолитического синапса и лизисом раковой клетки [14] [15].
Фактически происходит имитация физиологических процессов, наблюдаемых в ходе T-клеточной атаки опухолевых клеток. Такой механизм действия делает тарлатамаб особенно актуальным в лечении мелкоклеточного рака легкого.
Учитывая особенности механизма действия тарлатамаба, его применение несет риски развития цитокинового шторма, синдрома нейротоксичности, ассоциированного с иммунными эффекторными клетками (ICANS), а также связанных неврологических событий — все они, будучи в целом успешно купируемыми стандартными методами, являются характерными для T-клеточной иммунотерапии.
РЫНОЧНАЯ ОБСТАНОВКА
Когда в конце августа 2019 года «ЭббВи» (AbbVie) сообщила о полном сворачивании программы сокрушительно провалившегося ровалпитузумаба тесирина (rovalpituzumab tesirine, Rova-T) — конъюгата моноклонального антитела, таргетированного на DLL3 и несущего цитотоксический пирролобензодиазепин (PBD), — можно было подумать, что DLL3 вообще не состоятелен как терапевтическая мишень в задаче лечения мелкоклеточного рака легкого (МРЛ).
Более того, «ЭббВи» прилично разорилась: за покупку «Стемсентрикс» (Stemcentrx), оригинатора Rova-T, в апреле 2016 года было выложено $5,8 млрд наличными и в акциях.
Успех тарлатамаба (tarlatamab) вернул уверенность в оправданности DLL3-нацеливания. Впрочем, совсем немногие игроки фармотрасли продолжают обкатывать эту тему.
Так, «Харпун терапьютикс» (Harpoon Therapeutics) совместно с «Рош» (Roche) развивает HPN328 — лекарственное соединение, относящееся к триспецифическим активирующим T-клетки конструкциям (Tri-specific T cell-Activating Construct, TriTAC). В клиническом испытании NCT04471727 фазы I/II, согласно промежуточным результатам, среди пациентов с МРЛ был получен 48-процентный (n=11/23) объективный ответ и 32-процентный (n=6/19) подтвержденный объективный ответ.

Harpoon Therapeutics: новая модальность иммуноонкологического лечения
Триспецифические активирующие T-клетки конструкции (TriTAC) как усовершенствованный вариант BiTE-антител.
Сама «Рош» исследует мультиспецифическое антитело RO7616789, таргетированное на DLL3, CD137 и CD3.
«Фейниз терапьютикс» (Phanes Therapeutics) трудится над биспецифическим антителом PT217, связывающим DLL3 и CD47.
Не забыты биспецифические антитела, по аналогии с тарлатамабом связывающие DLL3/CD3 : «Бёрингер Ингельхайм» (Boehringer Ingelheim) пробует силы с BI 764532, а китайская «Чилу фармасьютикал» (Qilu Pharmaceutical) тестирует QLS31904.
Особняком стоит терапия естественными киллерами (NK-92) — CAR-трансдуцированными вектором, кодирующим scFv-домен против DLL3: ее проверяет Онкологический институт и больница Тяньцзиньского медицинского университета (TMUCIH).