Главное
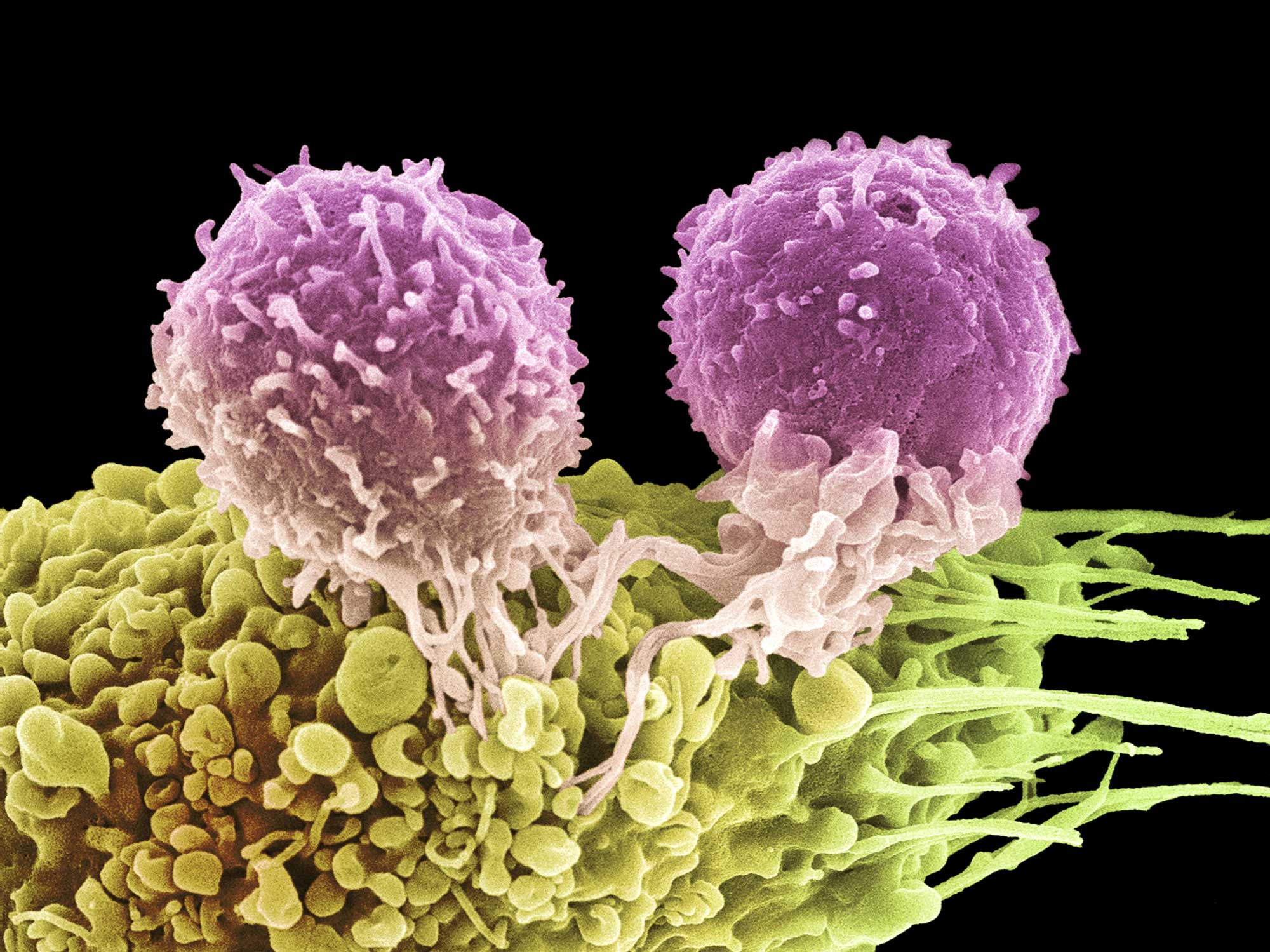
Терапия при помощи T-клеток с химерным антигенным рецептором (CAR-T), направленная против В-лимфоцитарного антигена CD19 продемонстрировала высокую эффективность лечения B-клеточных злокачественных опухолей.
Одобрены соответствующие CAR-T-препараты, более чем успешно применяемые в лечении таких гематоонкологических заболеваний, как B-крупноклеточная лимфома, фолликулярная лимфома, мантийноклеточная лимфома, B-клеточный острый лимфобластный лейкоз, острый лимфобластный лейкоз из клеток-предшественников B-лимфоцитов:
- «Кимрая» (Kymriah, тисагенлеклейцел);
- «Йескарта» (Yescarta, аксикабтаген цилолейцел);
- «Текартус» (Tecartus, брексукабтаген аутолейцел);
- «Бреянзи» (Breyanzi, лисокабтаген маралейцел).
С учетом того, что CAR-T-клетки против CD19 также нацелены на аутореактивные B-клетки, виновные в развитии аутоиммунных заболеваний, была осуществлена проверка гипотезы о возможности CAR-T-лечения таких тяжелых болезней, как системная красная волчанка, идиопатический воспалительный миозит, системный склероз. И всё получилось наилучшим образом.
Однократное вливание аутологичных CAR-T-клеток против CD19 обеспечило стойкую безлекарственную ремиссию указанных аутоантителозависимых аутоиммунных заболеваний, а само лечение характеризовалось очень хорошей переносимостью. Что примечательно, все пациенты прекратили прием иммуносупрессивных препаратов, включая глюкокортикоидные.
Высказано предположение о возможности полного излечения аутоиммунных заболеваний, хотя для окончательного подтверждения требуются более длительные наблюдения. Беспрецедентная ремиссия примечательна тем, что пул B-клеток со временем полностью восстановился, то есть фактически «перезагрузившиеся» защитные иммунные функции организма не пострадали.
Подобных результатов лечения серьезных мультисистемных заболеваний изредка можно добиться при помощи аутологичной трансплантации стволовых клеток, но с риском значительных токсических эффектов и даже смерти.

Kyverna Therapeutics: клеточная терапия против аутоиммунных заболеваний
CAR-T-клетки, которые могут вылечить волчаночный нефрит, системный склероз, миастению гравис, рассеянный склероз, болезнь Крона, язвенный колит.
Клинические подробности
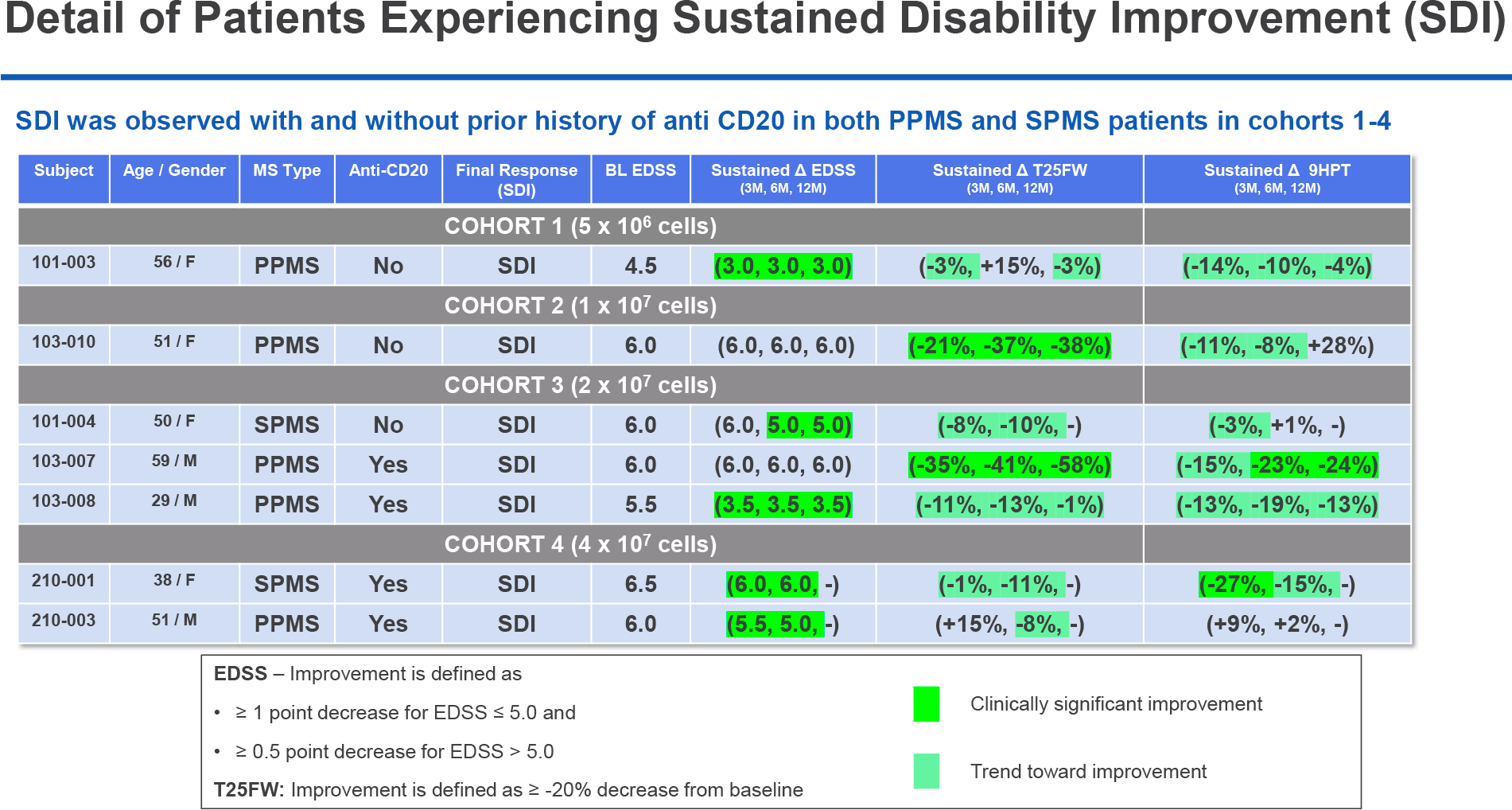
Исследование серии случаев охватило взрослых пациентов (n=15) с рефрактерными к лечению аутоиммунными заболеваниями: системной красной волчанкой (n=8), идиопатическим воспалительным миозитом (n=3), системным склерозом (n=4).
Испытуемые характеризовались признаками активного органного поражения, безуспешностью многочисленных иммуномодулирующих терапевтических подходов, серьезным, прогрессирующим или жизнеугрожающим течением болезни.
После прохождения процедуры лимфодеплеции флударабином и циклофосфамидом все участники получили однократное вливание аутологичных CAR-T-клеток MB-CART19.1 в дозе 1✕106 клеток/кг. Затем проводилась профилактика пероральным ацикловиром и котримоксазолом на протяжении как минимум 3 месяцев — до момента достижения стабильного уровня T-лимфоцитов CD4+ выше 200 клеток/мкл.
MB-CART19.1, производимый за две недели для каждого пациента на индивидуальной основе, представлен аутологичными CD4- и CD8-обогащенными Т-клетками, трансдуцированными самоинактивирующимся лентивирусным вектором, экспрессирующим химерный антигенный рецептор (CAR) против CD19. В код вектора также добавлена информация о CD8-производной шарнирной области, TNFRSF19-производном трансмембранном домене, внутриклеточном домене CD3ζ и костимулирующим домене 4-1BB.
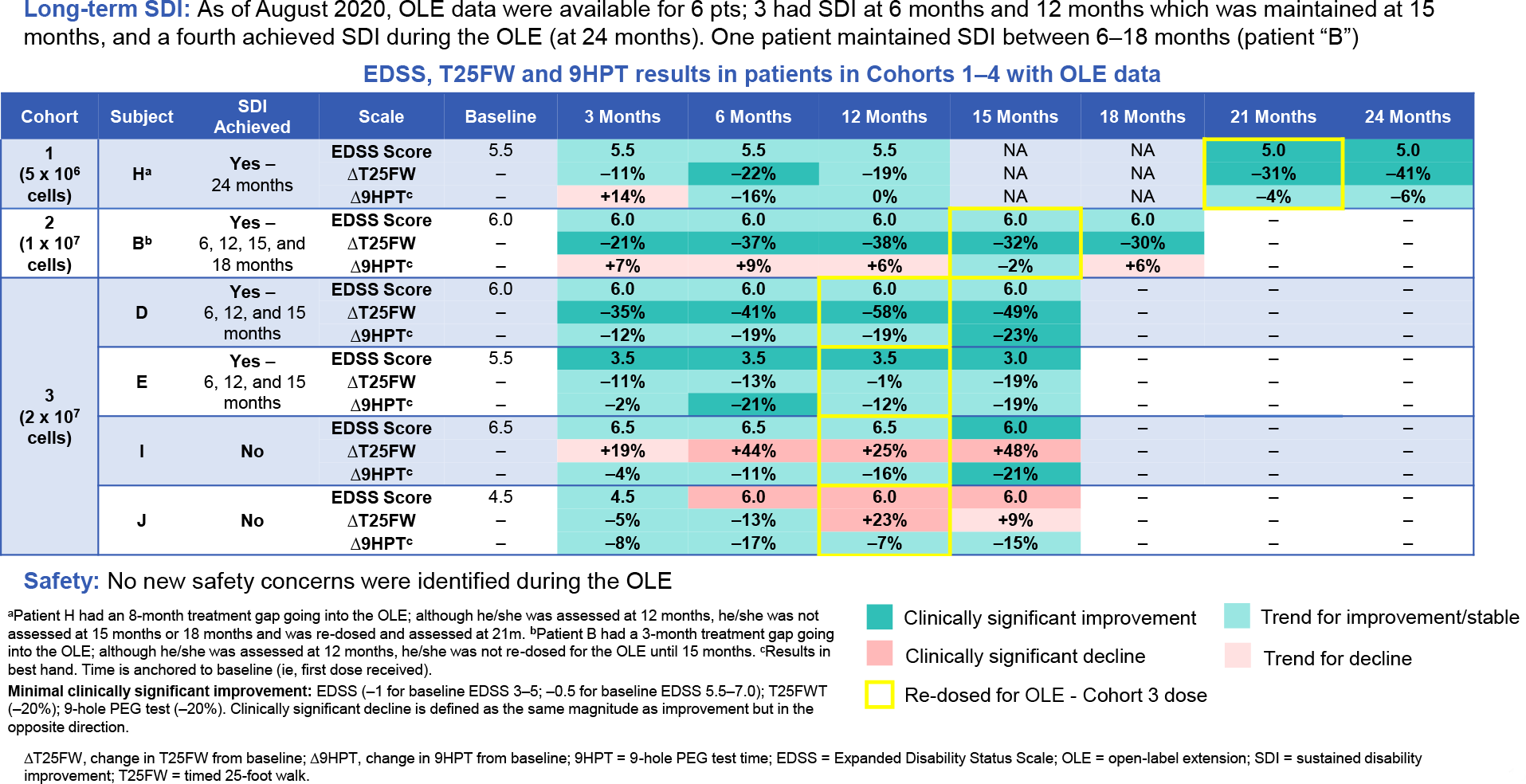
Продолжительность заболевания до экспериментального CAR-T-лечения составила медианных 3 года (1–20). Все пациенты потерпели неудачу как минимум после 2 предшествовавших иммуносупрессивных терапевтических курсов (медианных 5 [2–14]). Наблюдения после начала исследования продолжались на протяжении медианных 12 месяцев (2–28).
После вливания CAR-T-клеток их популяция быстро увеличивалась in vivo, продолжаясь в среднем до 8,6±0,8 дня. На пике экспансии число циркулирующих CAR-T-клеток составляло медианных 146 клеток/мкл (межквартильный размах [IQR] 61–697).
Параллельно была отмечена стремительная элиминация B-клеток CD19+ из периферической крови, она завершилась в среднем за 5,9±2,2 дня. У 93% пациентов (n=14/15) восстановление B-клеточного пула состоялось в среднем через 112±47 дней. У оставшегося одного испытуемого, за которым наблюдали на протяжении 128 дней, процесс продолжается.
Восстановившиеся B-клетки характеризовались в основном наивным фенотипом (CD20+ CD27−). Быстро истощившиеся B-клетки памяти (CD20+ CD27+) вернулись к своему нормальному количеству на 12-м месяце, что свидетельствует о процессе созревания новых B-клеток после прохождения аутоиммунной CAR-T-терапии.
В период наблюдений медианных 15 месяцев (IRQ 7–19) все 15 пациентов полностью прекратили прием глюкокортикоидов и других иммуносупрессивных лекарственных препаратов.

Quell Therapeutics: T-клеточная терапия против аутоиммунных заболеваний
Регуляторные T-клетки для лечения сахарного диабета, болезни Крона, язвенного колита.
Системная красная волчанка
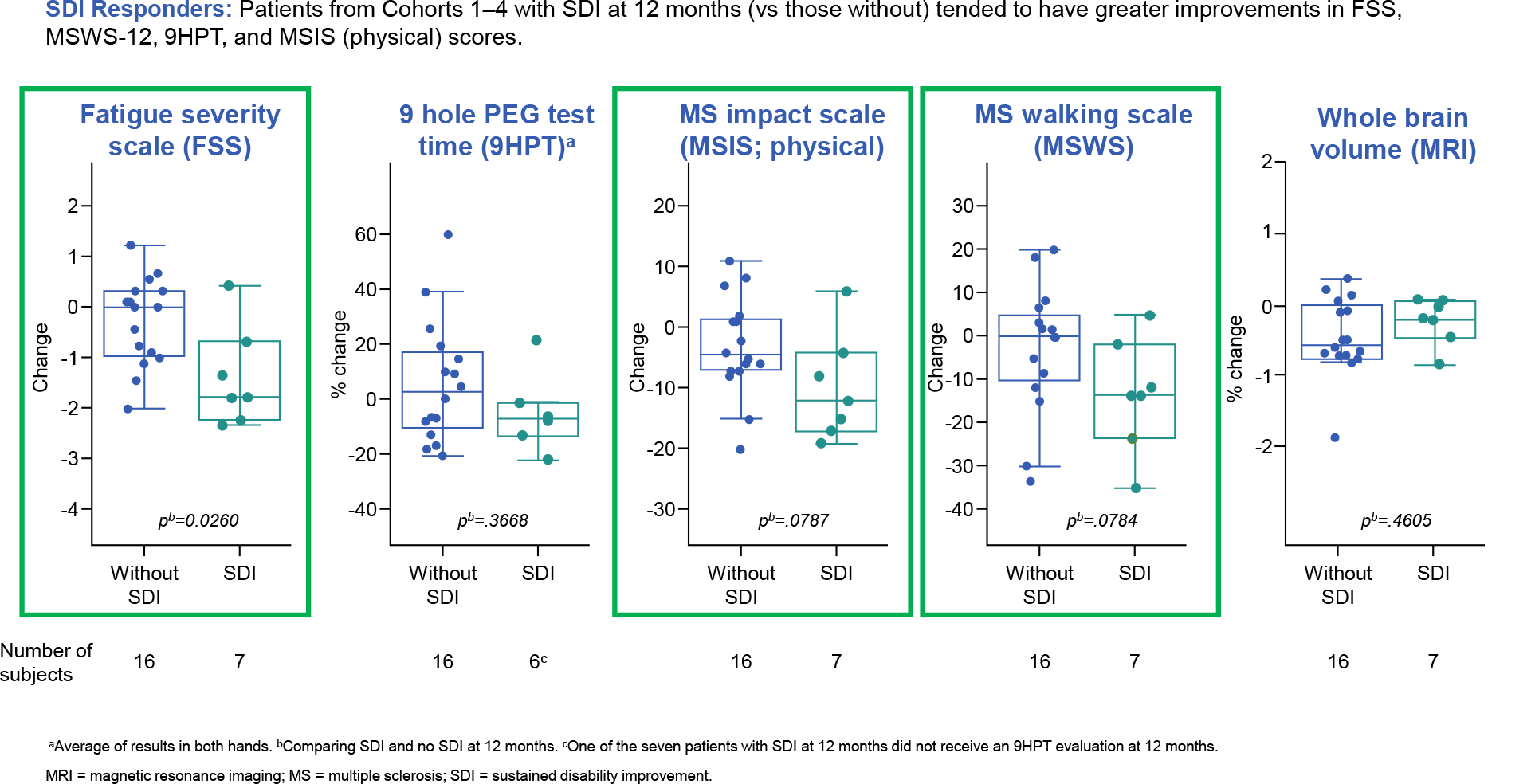
Все 100% пациентов (n=8/8) с системной красной волчанкой достигли полной ремиссии через 6 месяцев после аутоиммунной CAR-T-терапии MB-CART19.1, согласно критериям статуса низкой активности заболевания при волчанке (LLDAS) и определения ремиссии при системной красной волчанке (DORIS), продолжая поддерживать индекс активности заболевания при системной красной волчанке (SLEDAI-2K) на уровне 0.
Заболевание полностью разрешилось во всех своих основных категориях проявления, согласно тому, что индексы Британской группы по изучению системной красной волчанки (BILAG) снизились до 0, отразив исчезновение признаков и симптомов, относящихся к слизистым, опорно-двигательному аппарату, кардиореспираторной системе, нейропсихиатрии, гематологии, конституциональным особенностям, почечной системе.
У всех пациентов ремиссия сохранялась (0 баллов SLEDAI-2K) в период долгосрочных наблюдений вплоть до 29 месяцев.
Исчезли и оставались отрицательными антитела к двухспиральной ДНК (дсДНК), нормализовался уровень фактора комплемента С3, пропала протеинурия. У одного пациента, у которого через 4 месяца после аутоиммунной CAR-T-терапии протеинурия вновь проявилась и у которого последующая биопсия почек не выявила гистопатологических признаков волчаночного нефрита (но была сопутствующая подоцитопатия), рецидива не случилась, и через 24 месяца у него была лишь очень слабая протеинурия.
Идиопатический воспалительный миозит
По прошествии 3 месяцев после аутоиммунной CAR-T-терапии MB-CART19.1 у всех 100% пациентов (n=3/3) с идиопатическим воспалительным миозитом отмечен хороший клинический ответ, согласно изменению общего балла улучшения (TIS) по критериям Американской коллегии ревматологии (ACR) и Европейской лиги по борьбе с ревматизмом (EULAR), а также нормализация уровня креатинкиназы.
У всех пациентов зарегистрирована нормализация мышечной функции, согласно мануальному мышечному тестированию (MMT-8), и прекратилась внемышечная активность заболевания, согласно визуальной аналоговой шкале внемышечных симптомов (VAS-EM).
Все вышеуказанные благотворные изменения сохранялись вплоть до 12 месяцев наблюдений.
Системный склероз
Все 100% пациентов (n=4/4) с системным склерозом продемонстрировали снижение глобальной активности заболевания, согласно индексу активности Европейской группы по исследованию склеродермии (EUSTAR) при EULAR, и снижение кожной активности заболевания, согласно модифицированному кожному баллу Роднана.
Так, у 3 пациентов, наблюдавшихся не менее чем 6 месяцев после проведения аутоиммунной CAR-T-терапии MB-CART19.1, первый показатель изменился на медианных −4,2 балла (IQR −4,7 — −2,3), тогда как изменение второго показателя составило медианных −9 баллов (IQR −17 — −7).
Репертуар антител
У всех пациентов, прошедших анализ, титры антинуклеарных антител резко упали (более чем втрое): с исходных медианных 3200 (IQR 1000–6600) до 1000 (IQR 100–1000).
Анализ репертуара аутоантител у пациентов с системной красной волчанкой показал сероконверсию антител против двухспиральной ДНК (дсДНК), одноцепочечной ДНК (оцДНК), вторичных некротических клеток, нуклеосом и белка Смита. Долгосрочное наблюдение на протяжении не менее чем 1 года (7 из 8 пациентов) подтвердило устойчивое отсутствие специфических при системной красной волчанке аутоантител.
У пациентов с идиопатическим воспалительным миозитом и системным склерозом также продемонстрировано снижение титров специфических аутоантител.
Уровни защитных IgG-антител, сформированных после стандартной вакцинации против столбняка, кори, паротита, краснухи, вируса ветряной оспы, оставались стабильными, однако в ходе долгосрочного наблюдения было отмечено умеренное снижение, но не потеря антител против пневмококков и коронавируса SARS-CoV-2.
У пациентов, которые после аутоиммунной CAR-T-терапии и восстановления B-клеточного пула прошли вакцинацию против SARS-CoV-2, пневмококка или столбняка, уровни антиген-специфических IgG-антител повысились.
Безопасность
Экспериментальная аутоиммунная CAR-T-терапия MB-CART19.1 характеризовалась весьма благоприятным профилем безопасности.
Никто из пациентов не столкнулся с синдромом высвобождения цитокинов (CRS) и нейротоксичностью, связанной с иммунными эффекторными клетками (ICANS), которые проявились бы в тяжелой или жизнеугрожающей форме и серьезная выраженность которых типична для подобного рода лечения.
CRS был зарегистрирован у 73% испытуемых (n=11/15): у 10 человек в легкой форме (повышение температуры тела), у одного — в умеренной. Он проявился по прошествии медианного 1 дня (IRQ 1–7) и продолжался медианных 5 дней (IRQ 2–7). Назначение тоцилизиумаба потребовалось 6 пациентам. ICANS в легкой форме была зафиксирована у одного больного (головокружение) по истечении 2 недель после терапии, купирована глюкортикоидами.
У одного пациента по прошествии 120 дней после лечения наблюдалась тяжелая нейтропения, которая прошла после прекращения приема сертралина, прегабалина и доксазозина и после трех инъекций гранулоцитарного колониестимулирующего фактора.
Длительной (свыше 28 дней) или двухфазной супрессии костного мозга отмечено не было.
Что касается долгосрочной безопасности аутоиммунной CAR-T-терапии MB-CART19.1, в разные периоды наблюдений были зарегистрированы инфекции, протекавшие в легкой форме и проявлявшиеся главным образом поражением верхних дыхательных путей. Один пациент был госпитализирован по причине пневмонии, развившейся через 7 недель после лечения и успешно купированной антибиотиками.





Экспертные комментарии
Основной проблемой, связанной с безопасностью противораковой CAR-T-терапии, является воспалительная реакция, неразрывно связанная с большим количеством уничтоженных клеток. При онкологических заболеваниях, когда массовая гибель клеток носит шквальной характер, может развиться синдром выброса цитокинов в тяжелой или жизнеугрожающей форме, проявляющийся высокой температурой, нарушением дыхательных функций, отказом основных органов.
В ходе CAR-T-лечения аутоиммунных заболеваний случаи синдрома выброса цитокинов в основном шли с легкой степенью тяжести, и с ними удалось справиться в обычном порядке. Легкая форма этого нежелательного явления объясняется, вероятно, тем, что количество уничтожаемых B-клеток-мишеней существенно меньше, чем при онкопатологиях. Кроме того, можно снизить количество вливаемых терапевтических CAR-T-клеток, тем самым ограничив их потенциальную токсичность.
Частота инфекций была низкой, а общий уровень иммуноглобулинов снизился лишь умеренно. Несмотря на снижение уровня иммуноглобулинов, обусловленное уничтожением продуцирующих антитела плазмобластов, значительная часть сывороточных иммуноглобулинов, таких как поствакцинальные антитела, не была уничтожена: кажется, CD19-отрицательные плазматические клетки не подвергаются существенному воздействию аутоиммунной CAR-T-терапии. Поскольку долгоживущие плазматические клетки меньше страдают от такой терапии, остается открытым вопрос о необходимости новых вакцинаций и о том, как они повлияют на восстановление сегмента В-клеток памяти.
При лейкозах раннее повторное появление нормальных B-клеток коррелирует с рецидивом заболевания. Однако в нашем случае подобного не наблюдалось: восстановление B-клеточного пула не сопровождалось рецидивом. Опять же, созревание новых B-клеток убедительно свидетельствует о том, что функциональные CAR-T-клетки в организме не сохраняются.
Разрешение симптомов аутоиммунных заболеваний, сопровождающееся лишь острой аплазией B-клеток, является, есть мнение, результатом «глубокой перезагрузки»: репертуар B-клеточных рецепторов, согласно иммунному фенотипированию, значительно изменился в сравнении с тем, каким он был до CAR-T-терапии. Напротив, лечение гематоонкологических заболеваний препаратами на базе клеток CAR-T приводит к тому, что последние циркулируют в организме долгие годы, что отражается длительной B-клеточной аплазией [1]. Подобные кардинальные отличия в персистировании связаны, возможно, с различными клеточными нишами для CAR-T-клеток памяти [2]: при онкопатологиях они аккумулируются в костном мозге, при аутоиммунных заболеваниях — во вторичных лимфоидных органах.
Интересен вопрос с лимфодеплецией. Перед вливанием CAR-T-клеток пациенты получали флударабин и циклофосфамид по той же схеме, что и онкологические больные. Лимфодеплеция, как известно, улучшает приживление и пролиферацию CAR-T-клеток. Однако она и сама по себе могла опосредовать некоторое благоприятное воздействие на течение той же системной красной волчанки: согласно ряду исследований, высокодозная химиотерапия и аутологичная трансплантация гемопоэтических стволовых клеток способны положительно повлиять на течение этой болезни [3]. Впрочем, полное истощение пула В-клеток, исчезновение аутоантител и устойчивая безлекарственная ремиссия вряд ли могут быть вызваны только лимфодеплецией.
Без оглядки на весьма впечатляющие результаты, необходимы более убедительные и достоверные клинические данные, подкрепленные масштабными клиническими испытаниями с куда более продолжительным наблюдением. Кроме того, какие-то моменты с безопасностью, не исключено, могли быть упущены.
Как бы то ни было, нынешний обнадеживающий клинический ответ — наряду с рядом доклинических исследований в области других аутоиммунных состояний, инфекций, кардиометаболических расстройств, фиброза, старения [4] [5] [6] — открывает перспективы для применения CAR-T-терапии против широкого спектра заболеваний за пределами онкологических. Если при раке уничтожению подлежат почти все неопластические клетки, то при иных заболеваниях речь идет лишь о подмножестве патологических клеток. Вдобавок опухолевое микроокружение зачастую создает серьезное препятствие для CAR-T-терапии, тогда как при других болезнях клетки-мишени не локализованы в подобной недоступной и негостеприимной среде.